|
Modélisation macorscopique de l'évolution d'un système |
|
|
|
|
|
|
QCM N°
04
Modélisation
macroscopique de l’évolution d’un système
Les facteurs
cinétiques
La vitesse
d’évolution d’un système
La loi de
vitesse d’ordre 1
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Généralement,
l’évolution
d’un système
est d’autant
plus rapide
que : |
Du solvant
est ajouté |
Le volume du système
chimique
augmente |
La
concentration
des réactifs
augmente |
C |
|
2 |
Généralement, une élévation de
température : |
Augmente la
vitesse de
disparition
d’un réactif |
Diminue la
vitesse de
disparition
d’un réactif
|
N’a pas
d’influence
sur
la vitesse de
disparition
d’un réactif |
A |
|
3 |
La trempe :
|
Est un rinçage
du mélange
réactionnel |
Désigne un
refroidissement
brutal du
système |
Ralentit
l’évolution
d’un système |
BC |
|
4 |
Un
catalyseur : |
Augmente la
vitesse de
disparition
d’un réactif |
Figure dans
l’équation
d’une réaction |
Est présent
en fin de
réaction |
AC |
|
5 |
La catalyse est hétérogène quand
les
réactifs et le
catalyseur
sont : |
Dans la même
phase |
Dans des
phases
différentes |
solides |
B |
|
6 |
On considère
la réaction
d’équation :
H2O2 (aq)
+ 2 H+ (aq)
+ 2 I–
(aq) → 2 H2O (ℓ)
+ I2 (aq)
La vitesse
volumique d’apparition du diiode
est donnée par : |
|
|
|
A |
|
7 |
Le temps de
demi-réaction est : |
La durée
nécessaire à la
disparition
de la moitié
des réactifs |
La durée
nécessaire
à la
disparition
de la moitié
du réactif
limitant |
La moitié du
temps
nécessaire
pour que la
réaction soit
terminée |
B |
|
8 |
Sur le graphe ci-dessous, on représente les évolutions au cours du temps de la concentration en réactif limitant lors d’une réaction catalysée et d’une réaction non catalysée.
|
La
courbe
verte
traduit l’évolution d’une réaction catalysée |
La vitesse initiale de disparition du réactif limitant, déterminée par la
courbe
verte, est supérieure à celle déterminée à partir de la courbe rouge |
demi-réaction est plus faible pour le système dont l’évolution est représentée en rouge. |
|
|
9 |
L’évolution d’un système chimique peut être considéré comme terminée au
bout d’une durée
égale : |
Au temps de
demi-réaction |
À deux fois
le temps de
demi-réaction |
À plusieurs fois le
temps de
demi-réaction |
C |
|
10 |
Soit la réaction
d’équation : S2O82– (aq)
+ H2O (ℓ) → 2 SO42– (aq) + 1/2 O2 (g)
+ 2 H+ (aq) En solution diluée, si la réaction est d’ordre 1 par rapport
à S2O82–
(aq) : |
[S2O82–]t =
[S2O82–]0
× exp (–
k . t) |
vdisp (S2O82–)t
= k . t |
vdisp
(S2O82–)t
= k . [S2O82–]t |
AC |
|
11 |
Soit la réaction
d’équation : S2O82– (aq)
+ H2O (ℓ) → 2 SO42– (aq) + 1/2 O2 (g)
+ 2 H+ (aq) En solution diluée, si la réaction est d’ordre 1 par rapport à rapport à S2O82– (aq), le temps de
demi-réaction
t1/2 : |
Dépend de la
concentration
initiale
[S2O82–]0 |
Est
indépendant
de la
concentration
initiale
[S2O82–]0 |
Est tel
que :
|
B |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Les transformations quasi
instantanées.
Les transformations lentes.
Les transformations extrêmement
lentes ou infiniment lentes.
Facteurs cinétiques :
►
La température :
►
Ralentissement ou
arrêt d’une réaction chimique.
►
Influence de la
concentration des réactifs :
La catalyse :
►
Catalyse homogène :
►
Catalyse hétérogène :
|
|
|
Cu |
|
|
|
C2H5OH
|
+ O2 |
→ |
CH3CHO |
+ 2 H2O |
►
Catalyse enzymatique :
La vitesse d’évolution d’un système :
►
Vitesse volumique
d’apparition d’un produit P :
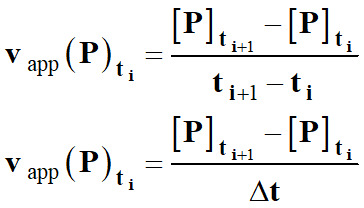
►
Vitesse volumique
d’apparition d’un produit P :
►
Remarque :
►
Vitesse volumique de
disparition d’un réactif R :
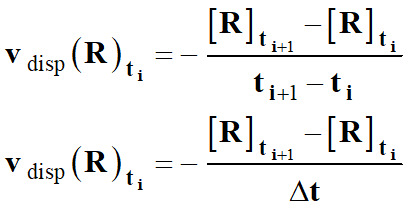
►
Vitesse volumique de
disparition d’un réactif R :
►
Remarque :
►
Vitesse volumique et
unités :
Temps de demi-réaction :
►
Temps de demi-réaction
à partir de l’évolution de la concentration d’un produit :
Loi de vitesse d’ordre 1 :
a A
+ b B
→ c C +
d D
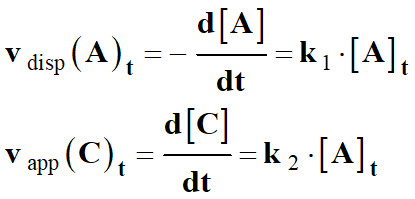
►
Reconnaître une loi de
vitesse d’ordre 1.
a A
+ b B
→ c C +
d D
►
Méthode 1 :
►
Méthode 2 :
►
Méthode 3 :
►
Remarques :
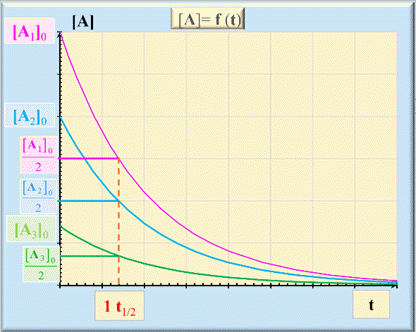
►
Autre caractéristique
du temps de demi-réaction t1/2 :
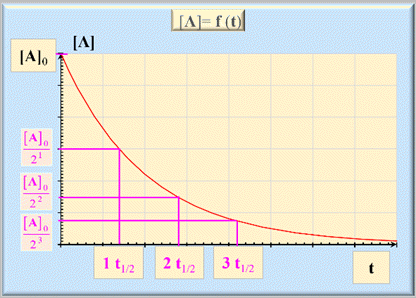
Évolution de la vitesse volumique au cours du temps (Loi
de vitesse d’ordre 1 ) :
|
|