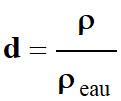|
Analyse d'un système chimique. |
|
|
|
|
|
|
QCM N° 02
Pour
chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’unité
usuelle de la
densité
est : |
kg . m−3 |
m3
. kg−1 |
Sans
unité |
C |
|
2 |
Deux
espèces en solution
à la même
concentration
en
quantité de matière sont
probablement identiques
si le
spectre UV-visible : |
sont
superposables |
présentent
le
même
maximum
d'absorption |
ont la
même
valeur
d'absorbance à λmax |
A |
|
3 |
L'exploitation d'un spectre
IR
permet : |
de
déterminer
la formule
brute
d'une
espèce chimique |
de
déterminer
la couleur
d'une
espèce
chimique |
d'identifier des
liaisons
présentes
dans une
molécule |
C |
|
4 |
La
conductivité d'une
solution
est une grandeur
représentant la capacité
de la
solution à : |
s'opposer
au
courant
électrique |
conduire
le
courant
électrique
|
produire
du
courant
électrique |
B |
|
5 |
Une droite
d'étalonnage
en
conductimétrie peut
être
obtenue en mesurant
la
conductivité : |
de
solutions de
même
composé
ionique
mais
de concentration
différente |
de
différentes
solutions
ioniques
de même
concentration |
d'une même
solution
ionique
à des
températures
différentes |
A |
|
6 |
La droite
d'étalonnage
obtenu
lors d'un dosage
spectrophotométrique
vérifie
l'équation :
A
= 240 C (C mol . L-1).
Une
solution de la même
espèce
dont la mesure
d'absorbance donne
A
= 1,20
est à une
concentration
en
quantité de matière
égale à :
|
5,0 mmol . L-1 |
200 mol . L-1 |
0,40 mol . L-1 |
A |
|
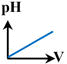
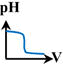
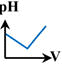
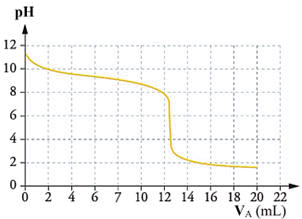
7 |
la courbe
représentant
le titrage
pH-métrique de
l'ammoniac
par
l'acide
chlorhydrique est : |
|
|
|
B |
|
8 |
Lors d’un
titrage l'équivalence correspond à l'état du système
pour lequel :
|
toute la
solution
de la
burette
a été
versée |
les
réactifs titrant
et titré
sont en
quantité
de matière
égale dans
le bécher |
les
réactifs titrant
et titré
ont été
introduits
en proportions
stœchiométriques |
C |
|
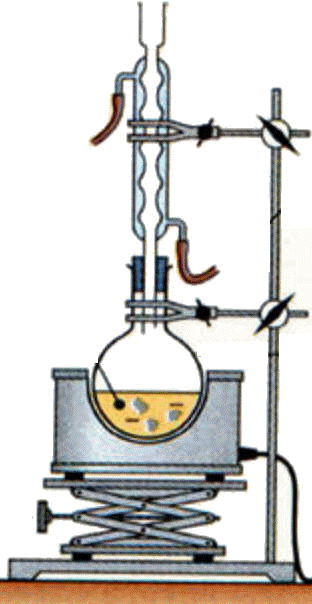
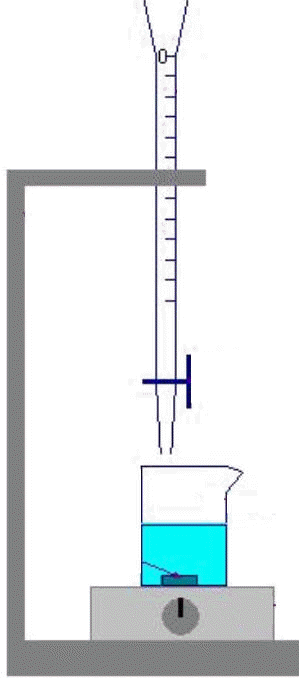
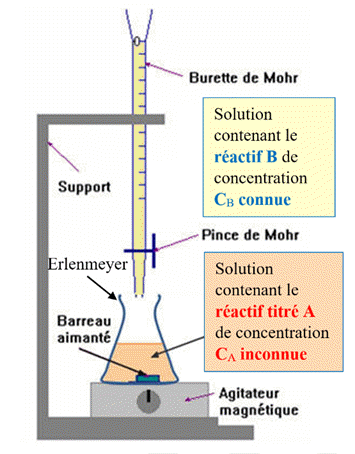
9 |
Le schéma
correct pour
représenter un dispositif
de titrage
est : |
|
|
|
B |
|
10 |
Pour une
solution de
concentration C d'une
espèce
absorbante,
la loi de
Beer-Lambert
permet
d'exprimer : |
C
en fonction
de la
longueur
d'onde de
mesure |
la
longueur
d'onde du
maximum
d'absorption en
fonction
de C |
l'absorbance de
la
solution, à une
longueur
d'onde
fixée en
fonction
de C |
C |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Densité d’un liquide :
-
La densité d d’un liquide, à une
température donnée, est le rapport
-
de la masse volumique du liquide ρ
-
sur la masse volumique ρeau
de l’eau.
|
|
|
|
d |
Densité sans
unité |
|
ρ |
Il faut
exprimer les deux masses
volumiques
dans la même unité
Le plus
souvent : (g . L–1) ou (kg . L–1)
ou (kg . m–3) |
Spectroscopie UV-visible.
-
Les solutions colorées absorbent certaines radiations dans le domaine du
visible, dont la longueur d’onde est comprise entre :
-
400 nm ≤ λ ≤ 800 nm
-
Les solutions incolores peuvent absorber des radiations dans le domaine
ultraviolet :
-
Pour une espèce chimique colorée, on peut tracer le graphe donnant l’absorbance
A en fonction de la longueur d’onde
λ.
-
On obtient alors le spectre d’absorption de l’espèce chimique.
-
Exemple : Spectre d’absorption du diiode :
-
La valeur de la longueur d’onde correspondant à l’absorbance maximale
du spectre d’absorption peut permettre l’identification d’une espèce chimique.
Spectroscopie infrarouge IR :
-
La spectroscopie IR est une
spectroscopie d’absorption.
-
Les composés organiques absorbent aussi
dans le domaine de l’infrarouge.
-
Pour ces spectres, on fait figurer :
-
La transmittance T ou intensité
lumineuse transmise par l’échantillon analysé en ordonnée (elle s’exprime en
pourcentage)
-
Le nombre d’ondes σ en abscisse.
-
Le nombre d’ondes σ est
l’inverse de la longueur d’onde λ.
-
Exemple : Spectre de la propanone.
-
Chaque bande d’absorption est
associée à un type de liaison, principalement caractérisé par les deux atomes
liés et la multiplicité de la liaison.
-
Un spectre infrarouge renseigne sur la
nature des liaisons présentes dans une molécule.
-
Les bandes d’absorption associées à
chacune des liaisons rencontrées en chimie organique correspondent à un domaine
de nombre d’ondes bien précis.
-
Une table des absorptions
caractéristiques des liaisons dans le domaine de l’IR donne les
fourchettes des nombres d’onde (souvent l’allure des bandes) pour différents
types de liaison.
-
Un spectre infrarouge nous renseigne sur
la nature des liaisons présentes dans la molécule et permet d’en identifier les
groupes caractéristiques.
Conductivité d’une solution :
-
Dans une solution électrolytique, ce
sont les ions qui sont responsables du passage du courant.
-
Un courant dans une solution est dû à
la circulation des ions positifs et négatifs se déplaçant en sens inverse.
-
Chaque ion dans la solution contribue à
la conductivité de celle-ci.
-
La conductivité σ de la solution
est égale à la
somme
des
conductivités
due aux
cations
et aux
anions.
Courbe d’étalonnage en conductimétrie :
Énoncé de la loi de Kohlrausch :
|
La
conductivité σ d’une
solution diluée d’une espèce ionique
dissoute est
proportionnelle à sa concentration molaire C en
soluté
apporté : |
|
σ
= k .
C |
|
σ
= k .
C |
C ;
concentration en mol . L– 1
|
|
k :
coefficient de proportionnalité en S . L .
m– 1. mol– 1
|
|
|
σ :
conductivité de la solution en S . m– 1
|
-
-
À partir de la mesure de la
conductivité d’une solution, on peut déterminer la valeur de sa concentration.
|
Réaliser un
dosage par étalonnage consiste à déterminer
la
concentration d’une espèce en solution en comparant
une grandeur
physique, caractéristique de la solution, à
la même
grandeur physique mesurée pour des solutions étalon. |
Courbe d’étalonnage par mesure de
l’absorbance d’une solution :
-
Absorbance en fonction de la concentration
-
Loi de Beer-Lambert :
|
L’absorbance
d’une solution diluée contenant une espèce colorée
est
proportionnelle à la concentration (effective)
C de cette espèce
et à
l’épaisseur ℓ (cm) de la solution traversée par le faisceau
lumineux. |
|
A
(λ) =
ε (λ)
. ℓ .
C |
|
A :
absorbance : grandeur sans unité |
|
ℓ :
largeur de la cuve (épaisseur de la solution traversée) (cm) |
|
ε
(λ) : coefficient
d’extinction molaire (mol– 1. L. cm– 1) |
|
C :
concentration de l’espèce absorbante (mol
. L– 1) |
-
La courbe A = f
(C) constitue la courbe d’étalonnage de la substance étudiée.
-
Elle permet de déterminer la
concentration d’une solution de la substance étudiée.
-
Elle permet donc de doser une espèce
chimique colorée.
-
Exemple : Cas du diiode :
Titrage pH-métrique de l’ammoniac par l’acide chlorhydrique :
-
C’est la réaction entre une base faible
NH3 (aq) et un acide fort [H3O+
(aq) + Cl− (aq)]
-
Équation de la réaction :
H3O+ (aq) + NH3 (aq) → NH4+ (aq) + H2