|
Quantité de matière. Cours |
|
|
|
|
|
|
I-
La mole, unité de quantité de
matière.
Du microscopique au macroscopique. |
|
1)- Détermination du nombre d’Avogadro.
|
|
1)-
Exercice 2 page 91 : Déterminer la masse d’une molécule d’eau.
2)- Exercice
4 page 91. Déterminer un nombre d’entités.
3)-
Exercice 6 page 91. Calculer une quantité de matière.
4)- Exercice
10 page 92.
5)- Exercice 8 page 92 : Un chewing-gum à la nicotine.
|
|
|
I-
La mole, unité de quantité de matière.
1)- Changement d’échelle : Du microscopique au macroscopique.
-
L’échelle de l’infiniment petit, appelée échelle microscopique permet d’étudier
les atomes, les molécules et les ions.
-
Elle permet de considérer un atome de fer :
-
Masse d’un atome :
mFe
≈ 9,3
× 10–23 g.
-
À l’échelle humaine (notre échelle), c’est-à-dire l’échelle macroscopique, on
considère un morceau de fer de quelques grammes.
-
Exemple :
-
Si l’on veut réaliser la combustion du fer dans le dioxygène au laboratoire, on
peut utiliser un morceau de fil de fer de quelques grammes.
-
On ne travaille pas à l’échelle de l’atome.
-
On travaille à notre échelle, à l’échelle humaine, l’échelle macroscopique.
-
Question :
-
quel
est le nombre d’atomes de fer contenus dans un échantillon de fer de masse
m
≈ 3,5 g ?
-
Nombre d’atomes de fer contenus dans l’échantillon :
-
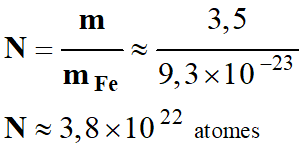 .
.
-
Conclusion : cette valeur est considérable !!!
-
Que représente ce nombre
N ?
ce nombre représente une quantité
de matière.
-
En chimie, la quantité de matière représente un nombre d’entités chimiques,
c’est-à-dire, un nombre d’atomes, de molécules ou d’ions.
-
Pour compter un grand nombre d’objets, on les regroupe en paquets.
-
Il existe beaucoup d’exemples : les œufs par douzaines, les chaussettes par
paires, les rames de papier par 500 feuilles, les bouteilles par six ou douze, …
-
Les entités chimiques comme, les atomes, les molécules et les ions, se comptent
aussi par paquet.
-
On appelle mole un paquet d’entités chimiques.
-
La mole est la réunion d'un nombre déterminé d’entités chimiques toutes
identiques.
-
Une quantité de référence a été choisie arbitrairement.
-
Elle est donnée par le Journal officiel du 23 décembre 1975.
-
On note :
-
NA
le nombre d’entités dans un paquet.
-
Un tel paquet porte le nom de mole.
-
La mole est une unité de quantité de matière de symbole : mol.
-
Définition :
-
La mole est la quantité de matière d'un système contenant autant d'entités
élémentaires qu'il y a d'atomes dans
-
Si l'on prend une mole d'atomes de carbone 12, la masse correspondante est de
-
Le paquet comprend
NA
atomes de carbone 12.
-
La détermination de la valeur de
NA
fut un grand défi pour la science.
3)- La constante d’Avogadro
NA.
-
Le nombre
NA
est défini par la relation suivante :
-
![]()
-
Par définition, on connaît la masse d’une mole atomes de carbone 12.
-
mais,
on a longtemps ignoré les valeurs de
NA
et de la masse d’un atome de carbone 12.
-
On doit à Jean Perrin la première détermination de
NA
en 1923.
-
Le nombre
NA
a été appelé constante d’Avogadro, en hommage à Avogadro, célèbre chimiste et
physicien italien (1776 – 1856).
-
Le nombre
NA
représente le nombre d’entités élémentaires par mol, on l’exprime en mol–1.
-
Des mesures récentes indiquent qu’il y a : 6,022137 x
1023 atomes de carbone 12 dans
-
NA
= 6,02
×
1023 mol–1.
-
Conséquence : une mole est un paquet de 6,02
×
1023 entités chimiques identiques.
-
Exemples :
-
Une mole d’atomes de fer contient 6,02
×
1023 atomes de fer.
-
Une mole de molécules d’eau contient 6,02
×
1023 molécules d’eau.
-
Une mole d’électrons contient 6,02
×
1023 électrons
-
Une mole d’ions chlorure contient 6,02
×
1023 d'ions chlorure.
-
La masse molaire d’une espèce chimique est la masse d’une mole de cette espèce
chimique.
-
On symbolise la masse molaire par M.
- La masse molaire s’exprime en g . mol–1.
-
La masse molaire atomique est la masse d'une mole d'atomes de l'espèce
considérée.
-
Dans la classification périodique, on donne les masses molaires atomiques des
éléments chimiques en tenant compte des proportions naturelles de ses isotopes.
-
Masse molaire atomique de l'élément carbone :
-
M (C)
= 12,0 g . mol–1.
-
Masse molaire atomique de l'élément oxygène :
-
M (O)
= 16,0 g . mol–1.
-
Masse molaire atomique de l'élément cuivre :
-
M (Cu)
= 63,5 g . mol–1.
-
Masse molaire atomique de l'élément cuivre :
-
M (Cl)
= 35,5 g . mol–1.
-
DDans la nature, il y a 75 % de l’isotope 35 et 25 % de l’isotope 37.
3)- La masse molaire moléculaire.
- La masse molaire moléculaire est la masse d'une mole de molécules de l'espèce
considérée.
-
La masse molaire moléculaire s'obtient en faisant la somme des masses molaires
atomiques des atomes qui constituent la molécule.
-
Exemples :
-
déterminer
la masse molaire moléculaire des espèces chimiques suivantes :
-
H2O
; Cl2 ; H2SO4 et NH3.
-
Masse molaire de la molécule d'eau :
-
M
(H2O)
= 2
M(O)
+
M
(H)
-
M
(H2O)
= 2
×
16,0 + 1
×
1,0
-
M
(H2O) ≈ 18,0
g . mol–1
-
Masse molaire du dichlore :
-
M
(Cl2)
= 2
M(Cl)
-
M
(Cl2)
= 2
×
35,5
-
M
(Cl2)
≈ 70,0
g . mol–1
-
Masse molaire de l'acide sulfurique :
-
M
(H2SO4)
= 2
M(H)
+
M
(S)
+ 4
M(O)
-
M
(H2SO4)
= 2
×
1,0 + 1
×
32,1 + 4
×
16,0
-
M
(H2SO4)
≈ 98,1
g . mol–1.
-
Masse molaire de l'ammoniac :
-
M
(NH3)
=
M(N)
+ 3
M
(H)
-
M
(NH3)
= 1
×
14,0 + 3
×
1,0
-
M
(NH3)
≈ 17,0
g . mol––1
- La masse molaire ionique est la masse d'une mole d'ions de l'espèce considérée.
-
On peut négliger la masse des électrons devant la masse du noyau d'un atome.
-
La masse molaire d'un ion monoatomique est pratiquement égale à celle de l'atome
correspondant.
-
Exemples :
-
M
(Na+)
≈
M
(Na)
-
M
(Cl–)
≈
M
(Cl)
-
Pour déterminer la masse molaire d'un ion polyatomique, on fait comme pour les
molécules.
-
Masse molaire de l'ion phosphate :
PO43– :
-
M
(PO43–)
=
M(P)
+ 3
M
(O)
-
M
(PO43–)
= 1
×
31,0 + 4
×
16,0
-
M
(PO43–)
≈ 95,0
g . mol–1
-
Masse molaire de l'ion sulfate SO42–
:
-
M
(SO42–)
=
M
(S)
+ 4
M(O)
-
M
(SO42–)
= 1
×
32,1 + 4
×
16,0
- M (SO42–) ≈ 96,1 g . mol–1.
III-
Masse molaire et quantité de matière.
-
Calculer la quantité de matière contenue dans
-
Résolution : le fer métal a une structure atomique, il faut utiliser la masse
molaire atomique de l'élément fer
-
Dans les tables :
M
(Fe)
≈ 55,8 g . mol–1 ≈ 55 g . mol–1.
-
À 1 mole de fer métal correspond environ
-
À 1/2 mole de fer métal correspond environ
-
On va utiliser un formalisme mathématique pour pouvoir résoudre tous les
exercices du même type :
-
Écriture symbolique :
-
Quantité de matière de l'espèce chimique considérée
A
:
-
nA
en mol
-
Masse molaire de l'espèce chimique considérée :
-
M
(A)
en g / mol
-
Masse de l'espèce chimique considérée :
-
mA
en g
-
Relations :
-
![]()
-
Quantité de matière de fer :
-
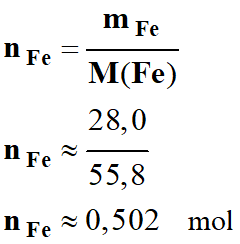
-
calculer
la masse de 0,500 mol de soufre
-
Données : M
(S)
= 32,1 g . mol–1 et
nS
= 0,500 mol.
-
On cherche mS.
-
Masse de soufre correspondant.
-
mS
=
nS
.
M
(S)
-
mS
= 0,500
×
32,1
-
mS
≈ 16,1 g
-
calculer
la quantité de matière d'eau n1 contenue dans un litre d'eau.
-
On donne : la masse d’un litre d'eau est m1 =
-
L'eau a une structure moléculaire de formule H2O.
-
Masse molaire de la molécule d'eau :
-
M
(H2O)
= 2
M(O)
+
M
(H)
-
M
(H2O)
= 2
×
16,0 + 1
×
1,0
-
M
(H2O) ≈ 18,0
g . mol–1
-
Quantité de matière contenue dans un litre d'eau :
- 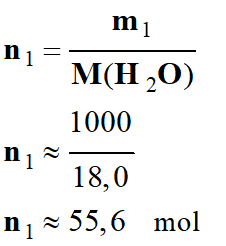
|
Énoncé : - des volumes égaux de gaz différents, pris dans les mêmes conditions de température et de pression,
renferment le même nombre de molécules. |
-
En conséquence, des volumes égaux de gaz différents, pris dans les mêmes
conditions de température et de pression, renferment le même nombre de moles.
-
Si l’on prend
-
D’autre part, une mole de dihydrogène, une mole de butane, une mole de méthane
occupent le même volume dans les mêmes conditions de température et de pression.
-
Ce volume est appelé, le volume molaire.
-
Loi d’Avogadro – Ampère :
-
Dans les mêmes conditions de température et de pression, tous les gaz ont le
même volume molaire.
-
Cette loi ne s’applique pas aux liquides et aux solides (états condensés).
-
Elle n’est valable que pour les gaz (état dispersé).
-
Le volume molaire d’un gaz est indépendant de la nature du gaz.
-
Il dépend de la température et de la pression.
-
On note
Vm
le volume molaire d’un gaz.
-
L’unité : L / mol.
-
Quelques valeurs du volume molaire :
|
Température
° C |
Pression
Pa |
Volume molaire
L.mol–1 |
|
|
0 |
1,013
× 105 |
22,4 |
C.N.T.P |
|
20 |
1,013
× 105 |
24,0 |
|
|
20 |
10,13
× 105 |
2,40 |
|
-
Comparaison des volumes occupés par une mole selon l’état physique.
-
Tableau :
|
Formule |
État physique
(CNTP) |
Volume molaire
Vm (L.mol –
1) |
Masse molaire
M
(g. mol – 1) |
Masse Volumique
ρ
(g .mL– 1) |
|
H2 |
Gaz |
22,4 |
2 |
8,9 × 10–5 |
|
CO2 |
Gaz |
22,4 |
44 |
2,0 × 10–3 |
|
N2 |
Gaz |
22,4 |
28 |
1,3 ×
10–3 |
|
H2O |
Liquide |
0,018 |
18 |
1,0 |
|
C (graphite) |
Solide |
0,0053 |
12 |
2,3 |
|
NaCl |
solide |
0,027 |
58,5 |
2,2 |
-
Quelles sont les remarques que l’on peut faire à la
llecture de ce tableau ?
3)- Gaz et quantité de matière.
Les relations :
-
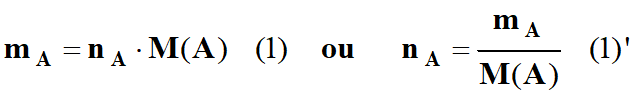
-
sont valables pour les solides, les liquides et les gaz.
-
Il est plus facile de mesurer le volume d’un gaz que sa masse.
-
Écriture symbolique (valable pour les gaz seulement)
-
Quantité de matière de l'espèce chimique gazeuse:
-
n
en mol
-
Volume molaire de l'espèce chimique considérée :
-
Vm
en L / mol
-
Volume de l’espèce chimique gazeuse :
-
V
en L
-
Relation :
![]()
1)- Détermination du nombre d’Avogadro.
|
1)-
Exercice 2 page 91 : Déterminer la masse d’une molécule d’eau.
2)- Exercice
4 page 91. Déterminer un nombre d’entités.
3)-
Exercice 6 page 91. Calculer une quantité de matière.
4)- Exercice
10 page 92.
5)- Exercice 8 page 92 : Un chewing-gum à la nicotine.
|
|
|