|
La solution hydroalcoolique et chromatographie Correction |
|
|
|
|
|
|
Matériel : élèves : |
papier
pour chromatographie – bécher – verre de montre Pince à épiler. Colorants : bleu patenté (E 131),
jaune (E102), vert. Éthanol, solution aqueuse de chlorure
de sodium ( |
|
Eau distillée, eau Oxygénée 10 vol.,
glycérol |
|
|
Verrerie |
Béchers, erlenmeyer, fiole jaugée
100mL Balance, Pipette graduée 10 mL, pipette
graduée 5 mL ou 2 mL Pissette d’eau distillée |
|
I- La solution hydroalcoolique.
|
I- La solution
hydroalcoolique.
1)- Les Solutions hydroalcooliques.
a)- Introduction.
-
Les Solutions hydroalcooliques sont
utilisées pour désinfecter les mains.
-
Ce sont des antiseptiques.
-
Elles contiennent de l’éthanol, du
glycérol, de l’eau oxygénée et de l’eau distillée.
-
Elles s’appliquent sur les mains sèches
et ne nécessitent pas de rinçage.
b)- Composition d’une solution hydroalcoolique.
Tableau :
|
|
Pourcentage volumique |
Densité |
|
Éthanol à 96 % |
85,0 % |
0,806 |
|
Eau oxygénée à 10 vol. |
4,00 % |
1,01 |
|
Glycérol |
1,50 % |
1,26 |
|
Eau distillée |
q.s.p 100 mL |
1,00 |
2)- Questions :
-
Faire une recherche sur les différentes
espèces chimiques présentes dans la solution hydroalcoolique.
-
Déterminer les volumes des différentes
espèces chimiques pour préparer 100 mL de solution.
-
Déterminer les masses des différentes
espèces chimiques pour préparer 100 mL de solution.
-
Élaborer un protocole expérimental afin
de préparer 100 mL de solution hydroalcoolique.
-
Préciser le matériel utilisé et les
différentes étapes.
3)- Réponses
-
Eau oxygénée à 10 volumes : peroxyde de
dihydrogène.
|
Synonyme |
Eau Oxygénée |
Pictogrammes
Attention : Provoque une sévère irritation des yeux En cas de contact avec les yeux, rincer avec précaution avec de l’eau. Ne pas utiliser de récipients en métal. |
|
Formule |
H2O2 |
|
|
Masse moléculaire |
34,01 g / mol |
|
|
Aspect |
Liquide incolore |
|
|
Densité à 20 ° C |
1,022 |
|
|
Solubilité dans l’eau |
Soluble |
|
|
L’eau oxygénée
est une solution aqueuse de peroxyde de
dihydrogène. La concentration
des solutions de peroxyde de
dihydrogène est indiquée en volumes ou en
mol / L. Une solution à
x volumes correspond au dégagement de
x litres de dioxygène par la décomposition
d’un litre de solution. La
correspondance est approximativement De 10 volumes
pour une concentration de 1,0 mol /L. |
||
-
Tableau : Concentration en
H2O2 :
pourcentage massique
|
Paramètres |
Concentration en H2O2 :
pourcentage massique |
||||||
|
Pourcentage |
10 |
30 |
35 |
50 |
60 |
70 |
100 |
|
Masse
volumique g
/ mL |
1,03 |
1,11 |
1,13 |
1,20 |
1,24 |
1,29 |
1,45 |
|
Température
de fusion °
C |
-6 |
-26 |
-33 |
-52 |
-56 |
-40 |
-0,43 |
|
Température
d’ébullition °
C |
102 |
106 |
108 |
114 |
119 |
125 |
150 |
-
L’éthanol 96 % :
|
Synonyme |
Alcool éthylique |
Pictogrammes
Attention : DANGER Liquide et vapeurs très inflammable. Provoque une sévère irritation des yeux. Tenir à l’écart d’une source de chaleur. En cas de contact avec les yeux, rincer avec précaution avec de l’eau. |
|
Formule |
C2H6O |
|
|
Masse
moléculaire |
46,07 g / mol |
|
|
Aspect |
Liquide incolore |
|
|
Température
de fusion |
– 114 °
C |
|
|
Température
d’ébullition |
78 à 78,5 ° C |
|
|
Densité à 20 ° C |
0,803 |
|
|
Solubilité dans
l’eau |
Soluble |
|
|
On utilise
l’éthanol comme solvant en pharmacie, en
cosmétologie…
L'éthanol
(alcool éthylique) est l’alcool que
l'on retrouve dans les boissons
alcoolisées. Des petites
quantités d'éthanol provoquent
un état euphorique. Des doses plus
importantes dépriment gravement le
système nerveux : Le mélange avec
l’eau se fait avec dégagement de
chaleur et contraction de volume. 1 V d’éthanol
plus 1 V d’eau donnent
1,92 V de mélange.
à
consommer avec modération ! |
||
-
Le glycérol :
|
Synonyme |
Glycérine |
Pictogrammes Produit
hygroscopique |
|
Formule |
C3H8O3 |
|
|
Masse
moléculaire |
92,09 g / mol |
|
|
Aspect |
Liquide
incolore |
|
|
Température
de fusion |
20 ° C |
|
|
Température
d’ébullition |
290 ° C |
|
|
Densité à 25 ° C |
1,250 |
|
|
Solubilité dans
l’eau |
Soluble |
|
|
Le glycérol est
un trialcool :
Le propan-1, 2, 3 -triol. Le glycérol est un sous-produit de la fabrication des savons
et des acides
gras.
Formule semi-développée
Formule topologique
|
||
-
Eau distillée :
|
Synonyme |
Eau |
Présentation |
|
Formule |
H2O |
|
|
Masse
moléculaire |
18,02 g / mol |
|
|
Aspect |
Liquide
incolore |
|
|
Température
de fusion |
0
° C |
|
|
Température
d’ébullition |
100 ° C |
|
|
Densité à 20 ° C |
1,000 |
|
|
Solubilité
dans l’eau |
Soluble |
|
|
L’eau distillée est une eau qui a subi une ou plusieurs distillations. Elle ne contient pas de sels minéraux ni de microorganismes. Mais, au contact de l’air ambiant, elle absorbe le dioxyde de carbone présent dans l’air. De plus, des microorganismes présents dans l’air, peuvent se retrouver dans l’eau distillée si elle est exposée
à l’air ambiant. |
||
-
Volumes des différentes espèces
chimiques pour préparer 100 mL de solution :
|
|
Pourcentage volumique |
Densité |
|
Éthanol à 96 % |
85,0 % |
0,806 |
|
Eau oxygénée à 10 vol. |
4,00 % |
1,01 |
|
Glycérol |
1,50 % |
1,26 |
|
Eau distillée |
qsp 100 mL |
1,00 |
-
Volume d’éthanol à 96 % :
-
Le pourcentage en volume de l’éthanol
de la solution hydroalcoolique est de 85 %.
-
Pour préparer 100 mL de solution
hydroalcoolique, il faut :
-
Véthanol
≈ 85,0 mL
-
Volume d’eau oxygénée à 10 vol. :
-
Voxy
≈ 4,00 mL
-
Volume de glycérol :
-
Vgly
≈ 1,50 mL
-
Volume d’eau distillée :
-
Quantité qsp :
-
On rajoute la quantité suffisante d’eau
distillée pour obtenir 100 mL de solution hydroalcoolique.
-
Masses des différentes espèces
chimiques pour préparer 100 mL de solution :
-
Masse d’éthanol à 96 % :
-
La densité de l’éthanol
déthanol
= 0,81 et la masse volumique de l’eau ρéthanol
= 1,00 g / mL
-
Or : ![]()
-
méthanol
= ρéthanol
.Véthanol
-
m
éthanol = déthanol
. ρeau
.Véthanol
≈ 0,806 x 1,00 x 85
-
m
éthanol ≈
68,5 g
-
Masse d’eau oxygénée à 10 vol. :
-
moxy
= ρoxy
.Voxy
-
moxy
= doxy
. ρeau
.Voxy
≈ 1,01 x
1,00
x 4,00
-
moxy
≈ 4,04 g
-
Masse de glycérol :
-
mgly
= ρgly
.Vgly
-
mgly
= dgly
. ρeau
.Vgly
≈ 1,26 x
1,00
x 1,50
-
mgly
≈ 1,89 g
-
Masse d’eau distillée : masse
nécessaire.
![]() Protocole expérimental afin de préparer
100 mL de solution hydroalcoolique :
Protocole expérimental afin de préparer
100 mL de solution hydroalcoolique :
-
Le matériel : une fiole jaugée de 100
mL.
-
Une balance :
-
Pipette graduée de 10 mL, munie de sa
propipette.
-
Pipette graduée de 2 mL ou 5 mL, munie
de sa propipette.
-
Béchers, erlenmeyer :
![]() Un mode opératoire :
Un mode opératoire :
-
Verser une quantité suffisante
d’éthanol 96 % dans un bécher.
-
Placer la fiole jaugée de 100 mL sur la
balance et appuyer sur le bouton « Tare ».
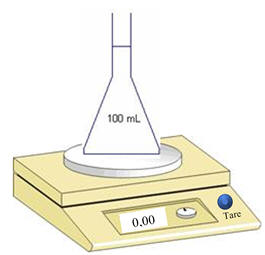
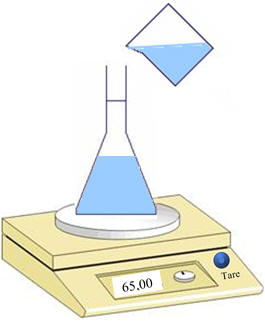
-
Verser environ 65 g d’éthanol 96 %.
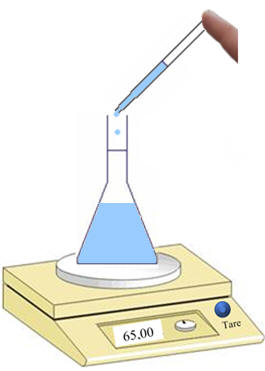
-
Puis ajuster la valeur avec une
pipette.
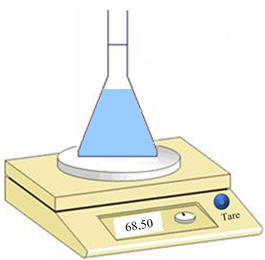
-
Verser une quantité suffisante d’eau
oxygénée 10 vol. dans un bécher de 100 mL.
-
Remplir la pipette graduée de 10 mL.
-
Verser la quantité nécessaire (4,0 mL)
dans la fiole jaugée.
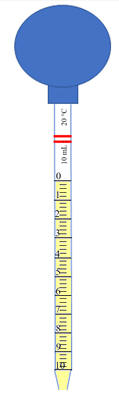
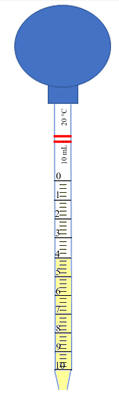
-
Verser une quantité suffisante de
glycérol dans un bécher de 100 mL.
-
Remplir la pipette graduée de 2,0 mL.
-
Verser la quantité nécessaire (1,5 mL)
dans la fiole jaugée.


-
Compléter la fiole jaugée avec de l’eau
distillée jusqu’au trait de jauge.
-
-
Mélanger. La solution hydroalcoolique
est prête.
-
-
La chromatographie permet de séparer
les espèces chimiques présentes dans un mélange homogène.
-
Elle est basée sur la différence de
solubilité d’une substance dans deux phases non miscibles :
-
la phase stationnaire (ou fixe) et
-
la phase mobile.
-
Au Lycée, on utilise la chromatographie
sur couche mince : C.C.M.
2)- La phase stationnaire.
-
Dans la chromatographie sur papier, la
phase fixe est constituée par de la cellulose ou par une fine couche de silice
hydratée.
-
Ce « papier » sert de support à la
phase mobile.

3)- La phase mobile ou éluant.
-
C’est un solvant dans lequel les
constituants du mélange sont plus ou moins solubles.
-
L’éluant migre le long de la phase fixe
par capillarité en entraînant plus ou moins fortement les constituants d’un
mélange à analyser.
-
C’est le phénomène d’élution.
- Remarque : l’éluant ne doit pas réagir avec les constituants à analyser.
- Il est choisi en fonction de son
attitude à dissoudre différemment les constituants du mélange à analyser.
4)- Vitesse de déplacement ou rapport frontal
Rf.
-
La séparation des composants, entraînés
par la phase mobile résulte de leur différence de solubilité entre les deux
phases.
-
Les composés dissous déposés se fixent
sur la phase fixe pour s’en arracher et monter avec la phase mobile.
-
Chaque constituant du mélange se
déplace avec sa propre vitesse derrière le front du solvant.
-
Une fois la migration terminée, on
détermine pour chaque constituant, la vitesse de déplacement ou le rapport
frontal Rf.
-
![]() .
.
III- Technique
de la chromatographie sur couche mince (C.C.M).
1)- Introduction.
-
La phase fixe :
-
On travaille avec plus de finesse en
utilisant une phase fixe élaborée :
-
Il s’agit d’un absorbant en poudre
(alumine, silice, …) déposé dans un gel en couche fine sur un support (plaque
d’aluminium, verre, film plastique, …).
-
La phase mobile :
-
C’est toujours un éluant liquide choisi
en fonction de l’absorbant et des composés à séparer.
2)- Mode opératoire :
![]()
a)- La plaque pour chromatographie :
-
Prendre une
plaque pour chromatographie
-
Ne pas toucher avec les doigts.
-
Tracer
délicatement au crayon de papier un trait léger à
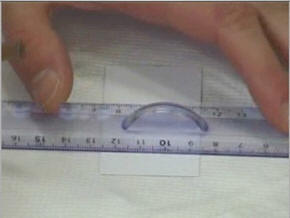
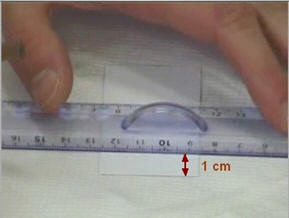


-
Déposer les gouttes de substance à
analyser sur le trait à l’aide de piques en bois.
-
Chaque dépôt doit être espacé d’un cm
au moins.
-
Repérer en haut de la feuille la
position et la nature des différents dépôts.
-
Il est placé dans un bécher de 100 mL.
-
La hauteur de l’éluant dans le bécher
doit être faible afin de ne pas immerger les différents dépôts.
-
Couvrir le bécher d’un verre de montre
afin de saturer l’intérieur du bécher en vapeur d’éluant.
-
On place la plaque côté trait de crayon
vers le bas dans le bécher et on recouvre du verre de montre.
-
Laisser
monter l’éluant jusqu’à
-
Sortir la plaque délicatement et la
laisser sécher.
- Elle peut se faire à la lumière naturelle ou sous éclairage U.V.
IV-
Chromatographie des colorants.
1)- Préparation de l’éluant.
- Prendre un bécher de 100 mL et
verser 1 mL d’éthanol et 5 mL d’une solution aqueuse de chlorure de sodium à
- Couvrir le bécher avec le verre de
montre.
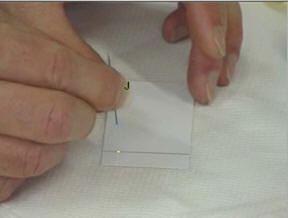
2)- Préparation du support.
- Prendre une plaque pour
chromatographie de
-
Tracer
délicatement un trait
léger au crayon de papier à
-
Repérer trois points équidistants sur
ce trait.
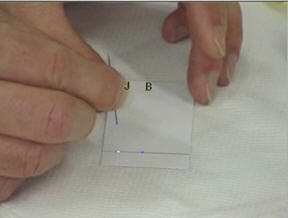
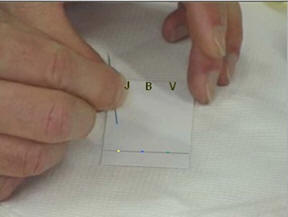
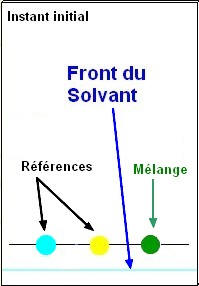
- Déposer à l’aide d’une pique en bois, une petite goutte de colorant jaune J,
- une petite goutte de colorant bleu
B et une
petite goutte de colorant vert V.
-
Noter en haut de la feuille la position
et la nature des différents dépôts.
|
Étape 1 :
|
Étape 2
|
Étape 3
|
3)- La
révélation.
|
- Placer la plaque dans le bécher
et recouvrir du
verre de montre. - Laisser évoluer l’ensemble jusqu’à ce que l’éluant arrive à
de la plaque environ. -
Sortir la plaque et
laisser sécher. |
|
4)- Exploitation.
- Repérer avec un crayon de papier la position finale de l’éluant.
- Observations. remarques. Conclusions.
- Calculer le rapport frontal Rf pour chaque constituant.

Animation
: réalisation d'une C.C.M
V- Conclusion.
- Qu’est-ce que la
chromatographie ? à quoi
sert-elle ?
|
|