|
La solution hydroalcoolique et chromatographie. énoncé. |
|
|
|
|
Matériel : élèves : |
papier
pour chromatographie – bécher – verre de montre Pince à épiler. Colorants : bleu patenté (E 131),
jaune (E102), vert. Éthanol, solution aqueuse de chlorure
de sodium ( |
|
Eau distillée, eau Oxygénée 10 vol.,
glycérol |
|
|
Verrerie |
Béchers, erlenmeyer, fiole jaugée
100mL Balance, Pipette graduée 10 mL, pipette
graduée 5 mL ou 2 mL Pissette d’eau distillée |
|
I- La solution hydroalcoolique. |
I- La solution
hydroalcoolique.
1)- Les Solutions hydroalcooliques.
a)- Introduction.
-
Les Solutions hydroalcooliques sont
utilisées pour désinfecter les mains.
-
Ce sont des antiseptiques.
-
Elles contiennent de l’éthanol, du
glycérol, de l’eau oxygénée et de l’eau distillée.
-
Elles s’appliquent sur les mains sèches
et ne nécessitent pas de rinçage.
b)- Composition d’une solution hydroalcoolique.
Tableau :
|
|
Pourcentage volumique |
Densité |
|
Éthanol à 96 % |
85,0 % |
0,806 |
|
Eau oxygénée à 10 vol. |
4,00 % |
1,01 |
|
Glycérol |
1,50 % |
1,26 |
|
Eau distillée |
q.s.p 100 mL |
1,00 |
2)- Questions :
-
Faire une recherche sur les différentes
espèces chimiques présentes dans la solution hydroalcoolique.
-
Déterminer les volumes des différentes
espèces chimiques pour préparer 100 mL de solution.
-
Déterminer les masses des différentes
espèces chimiques pour préparer 100 mL de solution.
-
Élaborer un protocole expérimental afin
de préparer 100 mL de solution hydroalcoolique.
-
Préciser le matériel utilisé et les
différentes étapes.
- Que signifie qsp
-
La chromatographie permet de séparer
les espèces chimiques présentes dans un mélange homogène.
-
Elle est basée sur la différence de
solubilité d’une substance dans deux phases non miscibles :
-
la phase stationnaire (ou fixe) et
-
la phase mobile.
-
Au Lycée, on utilise la chromatographie
sur couche mince : C.C.M.
2)- La phase stationnaire.
-
Dans la chromatographie sur papier, la
phase fixe est constituée par de la cellulose ou par une fine couche de silice
hydratée.
-
Ce « papier » sert de support à la
phase mobile.

3)- La phase mobile ou éluant.
-
C’est un solvant dans lequel les
constituants du mélange sont plus ou moins solubles.
-
L’éluant migre le long de la phase fixe
par capillarité en entraînant plus ou moins fortement les constituants d’un
mélange à analyser.
-
C’est le phénomène d’élution.
- Remarque : l’éluant ne doit pas réagir avec les constituants à analyser.
- Il est choisi en fonction de son
attitude à dissoudre différemment les constituants du mélange à analyser.
4)- Vitesse de déplacement ou
rapport frontal
Rf.
-
La séparation des composants, entraînés
par la phase mobile résulte de leur différence de solubilité entre les deux
phases.
-
Les composés dissous déposés se fixent
sur la phase fixe pour s’en arracher et monter avec la phase mobile.
-
Chaque constituant du mélange se
déplace avec sa propre vitesse derrière le front du solvant.
-
Une fois la migration terminée, on
détermine pour chaque constituant, la vitesse de déplacement ou le rapport
frontal Rf.
-
![]() .
.
III- Technique
de la chromatographie sur couche mince (C.C.M).
1)- Introduction.
-
La phase fixe :
-
On travaille avec plus de finesse en
utilisant une phase fixe élaborée :
-
Il s’agit d’un absorbant en poudre
(alumine, silice, …) déposé dans un gel en couche fine sur un support (plaque
d’aluminium, verre, film plastique, …).
-
La phase mobile :
-
C’est toujours un éluant liquide choisi
en fonction de l’absorbant et des composés à séparer.
2)- Mode opératoire :![]()
a)- La plaque pour chromatographie :
-
Prendre une
plaque pour chromatographie
-
Ne pas toucher avec les doigts.
-
Tracer
délicatement au crayon de papier un trait léger à
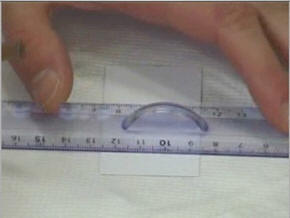
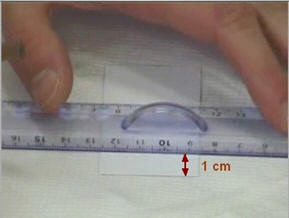


-
Déposer les gouttes de substance à
analyser sur le trait à l’aide de piques en bois.
-
Chaque dépôt doit être espacé d’un cm
au moins.
-
Repérer en haut de la feuille la
position et la nature des différents dépôts.
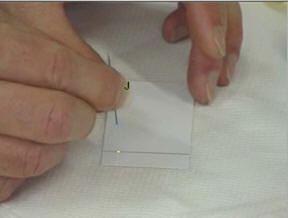
-
Il est placé dans un bécher de 100 mL.
-
La hauteur de l’éluant dans le bécher
doit être faible afin de ne pas immerger les différents dépôts.
-
Couvrir le bécher d’un verre de montre
afin de saturer l’intérieur du bécher en vapeur d’éluant.
-
On place la plaque côté trait de crayon
vers le bas dans le bécher et on recouvre du verre de montre.
-
Laisser
monter l’éluant jusqu’à
-
Sortir la plaque délicatement et la
laisser sécher.
- Elle peut se faire à la lumière naturelle ou sous éclairage U.V.
IV-
Chromatographie des colorants.
1)- Préparation de l’éluant.
- Prendre un bécher de 100 mL et
verser 1 mL d’éthanol et 5 mL d’une solution aqueuse de chlorure de sodium à
- Couvrir le bécher avec le verre de
montre.
2)- Préparation du support.
- Prendre une plaque pour
chromatographie de
-
Tracer
délicatement un trait
léger au crayon de papier à
-
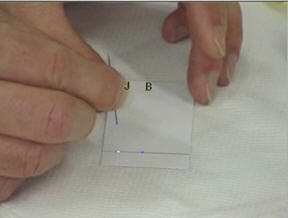
Repérer trois points équidistants sur
ce trait.
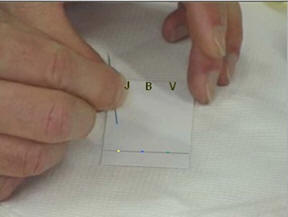
- Déposer à l’aide d’une pique en bois, une petite goutte de colorant jaune J,
- une petite goutte de colorant bleu
B et une
petite goutte de colorant vert V.
-
Noter en haut de la feuille la position
et la nature des différents dépôts.
|
Étape 1 :
|
Étape 2
|
Étape 3
|
3)- La
révélation.
|
- Placer la plaque dans le bécher et recouvrir du
verre de montre. - Laisser évoluer l’ensemble jusqu’à ce que l’éluant arrive à
de la plaque environ. -
Sortir la plaque et
laisser sécher. |
 |
4)- Exploitation.
- Repérer avec un crayon de papier la position finale de l’éluant.
- Observations. remarques. Conclusions.
- Calculer le rapport frontal Rf pour chaque constituant.
V- Conclusion.
- Qu’est-ce que la
chromatographie ? à quoi
sert-elle ?
|
|