|
Les solutions d'eau oxygénée |
|
|
|
|
|
|
1)- Les
solutions d’eau oxygénée. Énoncé |
1)- Les
solutions d’eau oxygénée.
–
La solution aqueuse de peroxyde de dihydrogène
est plus connue sous le nom d’eau oxygénée.
–
L’eau oxygénée dite à « 10 volumes » a un
pourcentage massique en peroxyde de dihydrogène égal à 3,0 %.
–
On trouve également des solutions à 10 %, 30
%, etc.
a)-
L’eau oxygénée est-elle un corps pur ?
b)- Il est possible de tracer l’évolution de la densité des solutions de peroxyde de dihydrogène
en fonction du pourcentage
massique en hydroxyde de dihydrogène :
–
Graphe :
–
Comment la densité d
des solutions de peroxyde de dihydrogène évolue-t-elle
en fonction du pourcentage massique en peroxyde de dihydrogène ?
–
Déterminer la valeur de la densité d’une
solution à 50 %.
c)-
Calculer la masse de peroxyde de dihydrogène
contenue dans 1,0 L de solution à 50 %.
d)-
Élaborer un protocole expérimental pour
déterminer le pourcentage massique d’une solution inconnue de peroxyde de
dihydrogène.
a)-
L’eau oxygénée est-elle un corps pur ?
–
L’eau oxygénée est une solution aqueuse de
peroxyde de dihydrogène.
–
C’est un mélange de molécule de peroxyde de
dihydrogène parmi des molécules d’eau.
–
En conséquence, ce n’est pas un corps pur.
b)-
Exploitation du graphe :
–
Comment la densité d
des solutions de peroxyde de dihydrogène évolue-t-elle
en fonction du pourcentage massique en peroxyde de dihydrogène ?
–
La densité
d des solutions de peroxyde de
dihydrogène augmente avec le pourcentage massique de peroxyde de dihydrogène.
–
La densité des solutions de peroxyde de
dihydrogène est comprise entre 1 et 1,45.
1 ≤
d ≤ 1,45
–
Déterminer la valeur de la densité d’une
solution à 50 %.
–
Valeur de la densité d’une solution à 50 % :
–
Par lecture graphique, on
obtient : d ≈ 1,2
c)-
Calculer la masse de peroxyde de dihydrogène
contenue dans 1,0 L de solution à 50 %.
–
Masse de 1 L de solution à 50 %
–
m = ρ .V
–
m = d . ρeau
.V ≈ 1,2 x
1,00 x 1,0 x
103
–
m ≈
1,2 x
103 g
–
Masse de peroxyde de dihydrogène :
–
mperoxy
= 50% m
–
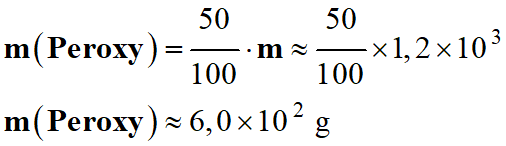
d)-
Élaborer un protocole expérimental pour
déterminer le pourcentage massique d’une solution inconnue de peroxyde de
dihydrogène.
–
Protocole expérimental :
–
Placer la fiole jaugée de 100 mL sur la
balance et appuyer sur le bouton « Tare ».
–
Verser la solution inconnue dans la fiole
jaugée jusqu’au trait de jauge.
–
Peser la fiole jaugée sur la balance.
–
Calculer la masse molaire puis la densité de
la solution inconnue.
–
Reporter la valeur de la densité sur le
graphique donné dans l’énoncé.
–
En déduire une valeur approchée du pourcentage
massique de la solution inconnue.
–
Tableau : Concentration en
H2O2 :
Pourcentage massique
|
Paramètres |
Concentration en H2O2 :
pourcentage massique |
||||||
|
Pourcentage |
10 % |
30 % |
35 % |
50 % |
60 % |
70 % |
100 % |
|
Masse
Volumique
g / mL |
1,03 |
1,11 |
1,13 |
1,20 |
1,24 |
1,29 |
1,45 |
|
Température
de fusion
° C |
-6 |
-26 |
-33 |
-52 |
-56 |
-40 |
-0,43 |
|
Température
d’ébullition
° C |
102 |
106 |
108 |
114 |
119 |
125 |
150 |
|
|