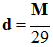|
Devoir : Énoncé |
Chimie et spéléologie
|
|
|
|
Chimie
et spéléologie
|
Dans le cadre d’un projet pluridisciplinaire sur le thème de la spéléologie, des élèves de terminale doivent faire l’exploration d’une grotte où ils risquent de rencontrer des nappes de dioxyde de carbone CO2. A teneur élevée, ce gaz peut entraîner des évanouissements et même la mort. Le dioxyde de carbone est formé par action des eaux de ruissellement acides sur le carbonate de calcium CaCO3 présent dans les roches calcaires. Le professeur de chimie leur propose d’étudier
cette réaction. |
|
Données : |
|
|
Température du laboratoire au
moment de l’expérience : |
25°C
soit T = 298 K |
|
Pression atmosphérique : |
Patm
= 1,020.105 Pa |
|
Loi
des gaz parfaits : |
P . V = n . R . T |
|
Constante des gaz parfaits : |
R
= 8,31 SI |
|
Masses molaires atomiques,
en g.mol-1 :
|
M (C)
= 12 ; M (H) = 1 ;
M (O) = 16 ; M (Ca)
= 40 |
|
Densité d’un gaz par
rapport à l’air : |
|
|
Dans un ballon, on réalise la réaction entre le carbonate de calcium CaCO3 (s) et l’acide chlorhydrique (H3O+(aq) + Cl–(aq)). Le
dioxyde de carbone formé est recueilli par déplacement d’eau, dans une
éprouvette graduée. Un élève verse dans
le ballon, un volume VS
= 100 mL d’acide chlorhydrique à 0,100 mol.L-1. A la date t = 0 s, il introduit rapidement dans le ballon 2,0 g de carbonate de calcium CaCO3 (s) tandis qu’un camarade déclenche un chronomètre.
Les élèves relèvent
les valeurs du volume V (CO2) de dioxyde de carbone
dégagé en fonction du temps. Elles sont reportées dans le tableau ci-dessous. La pression du gaz est égale à la pression
atmosphérique. |
|
t
(s) |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
140 |
160 |
180 |
200 |
220 |
240 |
|
V (CO2)
(mL) |
0 |
29 |
51 |
68 |
81 |
91 |
98 |
103 |
108 |
111 |
113 |
115 |
117 |
|
t
(s) |
260 |
280 |
300 |
320 |
340 |
360 |
380 |
400 |
420 |
440 |
460 |
480 |
500 |
|
V (CO2)
(mL) |
118 |
118 |
119 |
120 |
120 |
120 |
120 |
121 |
121 |
121 |
121 |
121 |
121 |
|
La
réaction chimique étudiée peut être modélisée par l’équation :
CaCO3(s)
+ 2 H3O+(aq)
= Ca2+(aq)
+ CO2 (g)
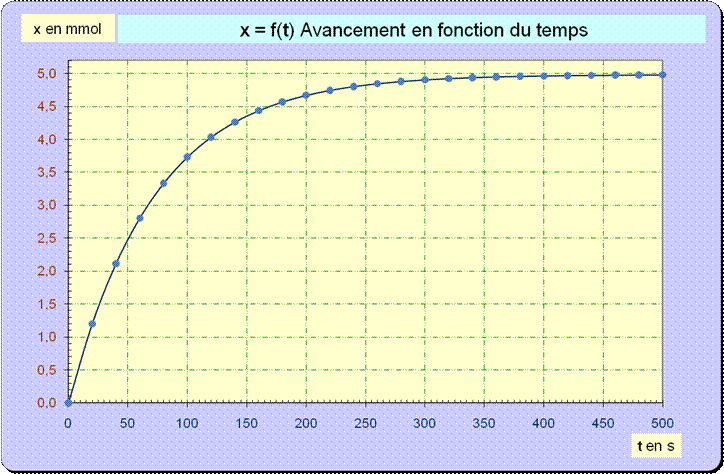
+ 3 H2O (l) 1. Calculer la densité par rapport à l’air du dioxyde de carbone CO2 (g). Dans quelles parties de la grotte ce gaz est-il susceptible de s’accumuler ? 2. Déterminer les quantités de matière initiale de chacun des réactifs. 3. Dresser le tableau d’avancement de la réaction. En déduire la valeur xmax de l’avancement maximum. Quel est le réactif limitant ? 4. Relations : a)- Exprimer l’avancement x de la réaction à une date t en fonction de V (CO2), T, Patm et R. b)- Calculer sa valeur numérique à la date t = 20 s. c)- Calculer le volume maximum de gaz susceptible d’être recueilli dans lesconditions de l’expérience. La transformation est-elle totale ? 5. Les élèves ont calculé les valeurs de l’avancement x et reporté les résultatssur le graphe donné en annexe (à rendre avec la copie). a)- Donner l’expression de la vitesse volumique de réaction en fonction de l’avancement x et du volume VS de solution. Comment varie la vitesse volumique au cours du temps ? Justifier à l’aide du graphe. b)- Définir le temps de demi-réaction t1/2. Déterminer graphiquement sa valeur sur l’annexe. 6. La température de la grotte qui doit être explorée par les élèves est inférieure à 25°C. a)- Quel est l’effet de cet abaissement de température sur la vitesse volumique de réaction à la date t = 0 s ? b)- Tracer, sur l’annexe, l’allure de l’évolution de l’avancement en fonction du temps dans ce cas. 7. La réaction précédente peut être suivie en mesurant la conductivité σ de la solution en fonction du temps. a)- Faire l’inventaire des ions présents dans la solution. Quel est l’ion spectateur dont la concentration ne varie pas ? b)- On observe expérimentalement une diminution de la conductivité. Justifier sans calcul ce résultat connaissant les valeurs des conductivités molaires des ions à 25°C :
λ (H3O+) = 35,0 mS.m ².mol
–1
λ (Ca2+) = 12,0 mS.m ².mol
–1
λ (Cl–) = 7,5 mS.m ².mol
–1 c)- Calculer la conductivité σ de la solution à l’instant de date t = 0 s. d)- Montrer que la conductivité est reliée à l’avancement x par la relation : σ = 4,25 – 580 x e)- Calculer la conductivité de la solution pour la valeur maximale de l’avancement. |
EXERCICE I : ANNEXE À RENDRE
AVEC LA COPIE
Cliquer sur l'image pour l'agrandir