|
Phys. N° 9 |
Le Gaz Parfait. Cours |
|
|
Programme 2010 : Physique et Chimie Programme 2020 :Physique et Chimie |
|
|
|
I - Les paramètres caractérisant l'état d'un gaz. |
|
2)- Equation d'état du gaz parfait. |
| Exercices (énoncé et correction) | |
|
Exercices 2005-2006 Physique et Chimie seconde Collection DURANDEAU HaCHETTE |
|
|
1)- Exercice 5 page 176. |
2)- Exercice 6 page 176. |
|
3)- Exercice 7 page 176. |
1)- Exercice 12 page 177. |
|
5)- Exercice 18 page 178. |
6)- Exercice 23 page 179 |
|
Physique et Chimie seconde Collection Microméga Hatier Ancienne édition |
|
|
1)- Exercice 8 page 298 |
2)- exercice 15 page 299 |
|
3)- exercice 16 page 299 |
4)- exercice 21 page 299 |
|
5)- exercice 26 page 300. |
|
|
|
I- Les paramètres
caractérisant l’état d’un gaz.![]()
1)- Situations de la vie courante.
- Si l’on place un ballon partiellement dégonflé au soleil, on remarque qu’il reprend son volume initial et qu’il est plus dur.
- Le volume d’un gaz contenu dans un ballon augmente avec la température.
- La pression d’un gaz augmente avec la température.
- Lorsqu’on gonfle un ballon, sa pression augmente.
- Il devient plus dur.
- Gonfler un ballon consiste à introduire de l’air dans le ballon.
- La pression d’un gaz augmente avec la quantité de matière du gaz et le volume d’un gaz augmente aussi avec la quantité de matière du gaz.
- La température, le volume, la pression et la quantité de matière d’un gaz sont des paramètres influant sur l’état d’un gaz.
- Ce sont des variables d’état.
- L’état d’un gaz dépend de quatre grandeurs macroscopiques :
- La pression p ;
- La température θ ;
- Le volume V;
- La quantité de matière n du gaz.
2)- Influence de chaque paramètre.
- À pression constante : à pression constante, le volume d’un gaz augmente avec la température.
- À volume constant : à volume constant, la pression augmente avec la température.
- À température constante : à température constante, la pression augmente quand le volume du gaz diminue.
- On dit que ces variables sont interdépendantes.
- Si l’on fait varier l’une d ‘elles, une autre au moins varie aussi.
II- Loi de Mariotte.
a)- Objectif : étudier comment varie, à température constante, la pression d’une quantité fixée de gaz en fonction du volume qu’il occupe.
b)- Dispositif expérimental :
- Schéma :
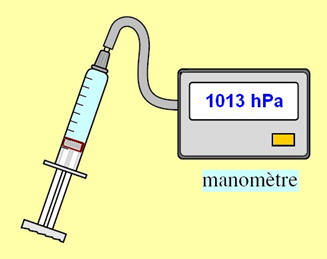
- Mode opératoire :
- une quantité d’air est enfermé dans la seringue graduée en mL.
- L’embouchure de la seringue est fermée par un capteur de pression.
- Le capteur de pression est gradué en hPa. Il donne la pression absolue.
a)- Les mesures :
- On déplace lentement le piston de la seringue.
- Pour différentes positions du piston, on relève les valeurs du volume V et de la pression p du gaz.
- On fait une dizaine de mesures.
Animation : CABRIJAVA
- Compléter le tableau suivant :
|
p hPa |
|
|
|
|
|
|
|
|
|
|
|
|
V mL |
|
|
|
|
|
|
|
|
|
|
|
|
1 / V
mL-1 |
|
|
|
|
|
|
|
|
|
|
|
- Tracer p = f (V) et p = f (1/V).
c)- Exploitation des graphes.
- À partir du graphique donner l’expression de p en fonction de V.
- déduire de ce résultat que le produit p.V est constant pour une quantité donnée de gaz, à température constante.
3)- Énoncé de la Loi de Mariotte.
|
- À température constante, - pour une quantité donnée de gaz, - le produit de la pression p par le volume V occupé par le gaz est constant : p.V = k. |
- On peut refaire l’expérience en modifiant la quantité de gaz utilisé et on peut refaire l’expérience en modifiant la température.
- Une étude plus approfondie montre que :
- À température constante, k dépend de la quantité de matière n de gaz utilisé ; k est proportionnel à n.
- À quantité de matière égale, k augmente avec la température.
- à faible pression et à une température donnée le produit p.V est le même quel que soit la nature du gaz.
III- Loi du gaz parfait.
- L’agitation des molécules constituant un gaz, sous faible pression caractérise son état thermique.
- L’agitation des molécules qui constituent un gaz est liée à une grandeur macroscopique :
- la température absolue du gaz, notée T.
- L’unité de température absolue est le Kelvin : symbole K.
- La température absolue étant liée à l’agitation des molécules d’un gaz, on ne peut pas refroidir indéfiniment un gaz.
- Lorsque la température diminue, l’agitation thermique diminue aussi.
- Lorsque les molécules sont immobiles, il n’y a plus d’agitation thermique et on ne peut plus refroidir : c’est le zéro absolu.
- En l’absence de toute agitation thermique la température T = 0 K.
- C’est le zéro absolu où toutes les particules sont immobiles.
- Au zéro absolu, la température absolue est nulle, la pression est nulle et il n’y a plus d’agitation thermique.
- La température absolue est une grandeur obligatoirement positive.
- Relation : l’échelle de température Celsius (température notée θ) se déduit de la température absolue par la relation :
|
T (K) = θ ° C + 273,15 |
2)- Équation d’état du gaz parfait.
- Les quatre paramètres pression p, volume V, température absolue T et quantité de matière n sont liés par une relation appelée : équation d’état du gaz parfait.
|
p . V = n . R . T |
{ |
p pression en pascal (Pa) |
|
V volume en mètre cube (m3) |
||
|
n quantité de matière en mole (mol) |
||
|
T température absolue en kelvin (K) |
- R est la constante du gaz parfait : R ≈ 8,31 J . K - 1 . mol - 1
- On appelle gaz parfait, le gaz pour lequel la relation précédente est vérifiée.
3)- Condition d’utilisation de l’équation d’état.
- Le gaz parfait est un modèle.
- Pour un gaz réel,
- p . V ≈ n . R . T si la pression est faible et si la température n’est pas trop basse.
- Dans les conditions habituelles de température et de pression, l’air (mélange de gaz) se comporte comme un gaz parfait.
- Calculer le volume molaire du gaz parfait dans les conditions normales de température et de pression.
- C.N.T.P : θ = 0 ,00 °C et p = 1013 hPa.
- Le volume molaire Vm est le volume d’une mole du gaz parfait : n = 1 et d’après l’équation état d’un gaz parfait :
|
Vm = |
R . T |
||
|
|
|
|
|
|
p |
|
||
|
|
8,31 x 273,15 |
||
|
Vm = |
|
||
|
|
1,013 x 10 5 |
||
|
|
|
||
|
Vm ≈ |
2,24 x 10 – 2 m 3 / mol |
||
|
Vm ≈ |
22,4 L / mol |
||
- Remarque :
- la formule
|
Vm = |
R . T |
|
|
|
|
p |
- montre que le volume molaire du gaz parfait dépend de la température et de la pression.
- La plupart des gaz sous des pressions inférieures à quelques bars se comportent comme un gaz parfait.
- Leur volume molaire est égal à celui du gaz parfait.
- C’est la Loi d’Avogadro – Ampère.
- Calculer le volume molaire du gaz parfait dans les conditions standard définies par :
- p = 1,00 bar et θ = 20,0 ° C.
-
1 bar = 105 Pa
|
Vm = |
R . T |
||
|
|
|
|
|
|
p |
|
||
|
|
8,31 x 293,15 |
||
|
Vm = |
|
||
|
|
1,00 x 10 5 |
||
|
|
|||
|
Vm ≈ |
2,44 x 10 – 2 m 3 / mol |
||
|
Vm ≈ |
24,4 L / mol |
||
| Exercices (énoncé et correction) | |
|
Exercices 2005-2006 Physique et Chimie seconde Collection DURANDEAU HaCHETTE |
|
|
1)- Exercice 5 page 176. |
2)- Exercice 6 page 176. |
|
3)- Exercice 7 page 176. |
4)- Exercice 12 page 177. |
|
5)- Exercice 18 page 178. |
6)- Exercice 23 page 179 |
|
Physique et Chimie seconde Collection Microméga Hatier Ancienne édition |
|
|
1)- Exercice 8 page 298 |
2)- exercice 15 page 299 |
|
3)- exercice 16 page 299 |
4)- exercice 21 page 299 |
|
5)- exercice 26 page 300. |
|