|
Contrôle N° 04 Chimie Février 2004 Terminale S énoncé |
|
|
|
I- Analyse d’une
solution commerciale d’acide chlorhydrique. |
I-
Analyse d’une solution commerciale d’acide chlorhydrique.
L’étiquette d’une bouteille contenant une solution S0 d’acide chlorhydrique porte les indication suivantes :
« Acide chlorhydrique, masse volumique μ = 1190 g / L,
Pourcentage massique P = 37 % »
On introduit un volume V = 4,2 mL de solution S0 dans une fiole jaugée de 500 mL contenant 100 mL d’eau distillée.
Puis on complète avec de l’eau distillée jusqu’au trait de jauge.
1)- Comment prélever 4,2 mL de solution S 0 ? (précautions et matériel)
Pourquoi a-t-on introduit de l’eau distillée dans la fiole jaugée avant d’introduire la solution d’acide chlorhydrique ?
2)- Déterminer l’ordre de grandeur de la valeur de la concentration
molaire C de la solution S préparée.
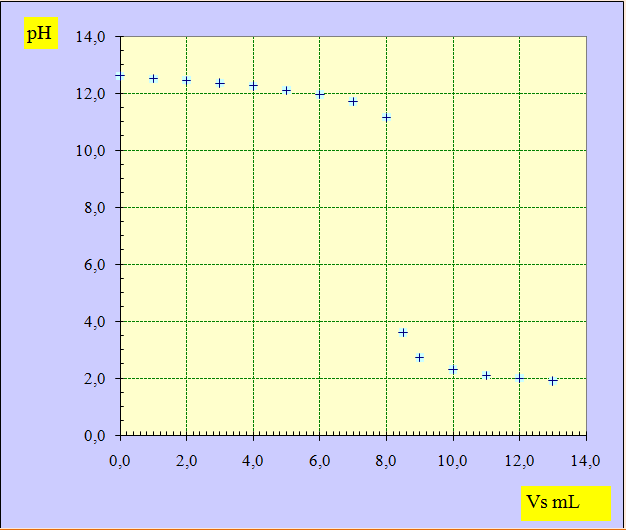
3)- Afin de vérifier cette concentration, on titre S par une solution aqueuse B d’hydroxyde de sodium (Soude).
La concentration de la solution est CB = 4,00 x 10 – 3 mol / L.
Dans un volume VB = 20,0 mL de solution B, on verse progressivement la solution S.
On mesure la valeur du pH après chaque ajout de volume VS (mL).
On obtient la courbe suivante :
|
Calculatrice autorisée et les mesures sont effectuées à 25 °C. Les couples de l’eau : H3O+ / H2O pKA1 = 0 et
H2O / HO – pKA2
= 14 |