|
Contrôle N° 03 décembre 1999 Première S énoncé |
|
|
|
|
II- Équilibre d'un solide en l'absence de frottements. |
I- Interaction.

Un objet de masse m = 100 g est maintenu par l'intermédiaire d'une ficelle (f).
On note :
![]() , poids de l'objet,
, poids de l'objet,
![]() , la force exercée par l'objet
sur la ficelle et
, la force exercée par l'objet
sur la ficelle et
![]() , la force
exercée par la ficelle sur l'objet.
, la force
exercée par la ficelle sur l'objet.
Comparer P, F1 et F2 et justifier chaque fois la réponse :
1)- L'objet est immobile.
2)- L'objet monte d'un mouvement rectiligne accéléré :
3)- L'objet descend d'un mouvement rectiligne uniforme.
II- Équilibre d'un solide en l'absence de frottements.

Deux chariots sont placés sur un banc à coussin d'air incliné d'un angle α = 20° par rapport à l'horizontale.
Sur chaque chariot, on a fixé un aimant.
Le chariot B est immobilisé et le chariot A est en équilibre : m = 536 g et g = 10 N / kg.
1)- Faire le bilan des forces agissant sur le chariot A.
Représenter ces forces dans le repère
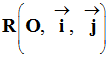 .
.
2)- Donner les conditions d'équilibre pour le chariot A.
3)- Donner l'expression littérale des coordonnées de chacune des
forces dans le repère
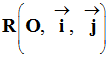 .
.
4)- En déduire la valeur de chacune des forces agissant sur le chariot A.
III- Action d'un acide sur un métal.
On introduit une masse m = 1,35 g de poudre d'aluminium dans un volume V = 100 mL d'une solution d'acide chlorhydrique de concentration C = 1,0 mol / L.
1)- Écrire l'équation bilan de la réaction. L'interpréter au sens de l'oxydoréduction.
2)- Calculer le volume de dihydrogène recueilli en fin de réaction (Vm = 24 L / mol dans les conditions de l'expérience). Justifier la réponse.
3)- Déterminer la concentration des ions présents dans la solution en fin de réaction.
IV- Une pile qui vaut de l'argent.
On réalise une pile en associant les deux demi-piles faisant intervenir les couples oxydant / réducteur suivants :
Au3+ / Au et Ag+ / Ag
1)- Dessiner cette pile, indiquer la polarité des électrodes et déterminer sa f.e.m. Donner son schéma conventionnel.
2)- nommer chaque électrode, donner les réactions aux électrodes et indiquer s'il s'agit d'une réduction ou d'une oxydation.
3)- Écrire l'équation bilan de la réaction qui s'effectue lorsque la pile débite du courant.
4)- On laisse la pile fonctionner pendant Δt = 3,0 h. On constate que la masse de l'électrode d'or a varié de m = 98 mg.
a)- La masse de l'électrode d'argent a-t-elle augmenté ou diminué ? Calculer la variation de masse m' de l'électrode d'argent.
b)- Calculer l'intensité supposée constante I du courant qui a circulé.
- Données :
- E0 (Ag+ / Ag) = 0,80 V ; E0 (Au3+ / Au) = 0,80 V ; NA = 6,02 × 10 23 mol–1
-
e =
1,60
× 10
– 19 C ; 1
F = 96500 C / mol, M
(Ag) = 108 g / mol ; M (Au) = 197 g / mol
|
|
|
|