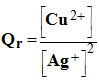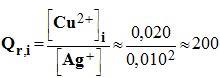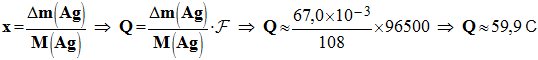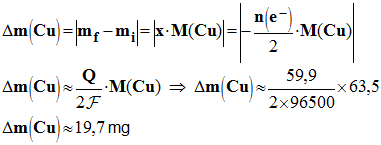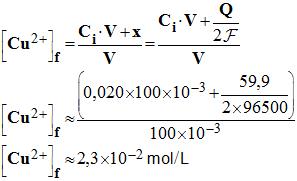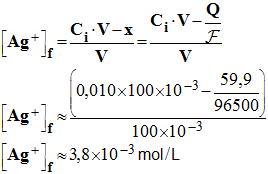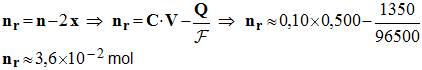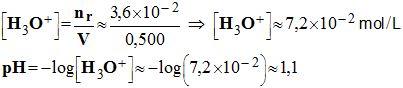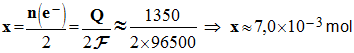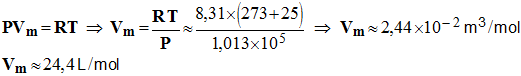Exercice
3 :
Pile ; électrolyse
I- Partie A : Étude d’une pile argent / cuivre
|
On s’intéresse à une pile constituée d’une demi-pile
Ag+
/ Ag
et d’une demi-pile
Cu2+
/ Cu reliées par
un pont salin.
La constante d’équilibre associée à la réaction :
est K = 2
× 10
15. Les concentrations des ions métalliques sont [Ag +] = 0,010 mol / L et [Cu 2+] = 0,020 mol / L.
Les solutions utilisées
ont chacune un volume
V = 0,100 L.
1)- Déterminer le quotient de réaction dans l’état initial. En déduire le sens d’évolution spontané de la réaction qui se produit dans la pile. - Expression du quotient de réaction de la réaction : - - Quotient de réaction à l’état initial : - - Évolution spontanée de la réaction : - Q r,i < K la réaction évolue dans le sens direct de l’écriture de l’équation de la réaction - (formation d’argent métallique et d’ions cuivre II et disparition de cuivre métal et d’ions argent I).
2)- Établir les équations des réactions se produisant aux électrodes puis l’équation de la transformation ayant lieu dans la pile. - Réactions aux électrodes :
- Équation de la transformation ayant lieu dans la pile :
3)- Indiquer la polarité de cette pile et son schéma conventionnel. Nommer les électrodes. - Polarité de la pile : - L’électrode d’argent constitue la borne positive de la pile et - l’électrode de cuivre constitue la borne négative de la pile. - Schéma conventionnel : - - Électrode d’argent : électrode positive : réduction : cathode - Électrode de cuivre : électrode négative : oxydation : anode.
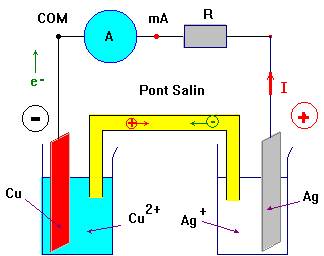
4)- Faire un schéma de la pile et y représenter le mouvement des différents porteurs de charges. - Schéma de la pile :
5)- Comment varient les concentrations en ions métalliques dans chaque demi-pile ? Comment est assurée l’électroneutralité de chaque solution au cours du fonctionnement de la pile ? - La concentration des ions argent diminue au cours du temps (ils disparaissent) et la concentration en ions cuivre II augmente au cours du temps (ils se forment). - La neutralité des solutions est assurée par le déplacement des ions positifs et négatifs qui se déplacent en sens inverse. - Exemple : - Les ions positifs présents dans le pont salin se déplacent vers le récipient contenant la solution aqueuse d’ions argent et les ions négatifs présents dans le pont salin se déplacent vers le récipient contenant la solution aqueuse d’ions cuivre II.
6)- Pour une durée de fonctionnement t, la variation de masse de l’électrode d’argent Δm(Ag) = 67,0 mg. Déterminer la quantité d’électricité Q mise en jeu ? - Quantité d’électricité mise en jeu : Q = n (e – ) . F - Il faut travailler avec une demi-équation électronique.
- En conséquence : n (e – ) = x et
7)- Déterminer la variation de masse de l’électrode de cuivre. - Variation de masse de l’électrode de cuivre :
- En conséquence : n (e – ) = 2 x. -
8)- Quelles sont les concentrations en ions métalliques après cette durée de fonctionnement t ? - Concentrations en ions métalliques : - Lorsque la pile débite, la concentration en ions cuivre II augmente. - Au bout de la durée Δt, elle a augmenté de x, avec n (e – ) = 2 x et le volume de la solution n’a pas varié. - - Lorsque la pile débite, la concentration en ions argent I diminue. - Au bout de la durée Δt, elle a diminué de x et le volume de la solution n’a pas varié. -
On donne :
M(Ag)
=
1
F
= 96500 C / mol
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
II- Partie B : Électrolyse d’une solution d’acide iodhydrique
|
On réalise l’électrolyse d’une solution aqueuse d’acide iodhydrique
(H
+aq+
I –
aq), entre des électrodes inattaquables de
platine, à Pour cela, on utilise un volume V = 500 mL d’une solution de concentration C = 0,10 mol / L. On observe la formation de diiode I2 en solution à l’anode et un dégagement de gaz à la cathode. Le gaz formé « aboie » en présence d’une flamme.
L’expérimentateur effectue l’électrolyse de la solution
pendant une
durée t
= 45 min,
sous un courant d’intensité
I =
1)- Écrire les équations des réactions se produisant aux électrodes, en déduire l’équation de la réaction d’électrolyse. - équations des réactions se produisant aux électrodes : - À l’anode, il se produit une oxydation :
- C’est l’électrode reliée à la borne positive du générateur. - À la cathode, il se produit une réduction : - Le gaz est du dihydrogène. On peut donner l’équation simplifiée :
- équation de la réaction d’électrolyse :
2)- Déterminer le pH de la solution initiale. - Valeur du pH de la solution initiale : par définition,
- pH
= – log [ H3O+]
= – log [H+]
=
1,0 3)- Calculer la quantité d’électricité Q qui a traversé l’électrolyseur, en déduire la quantité de matière en électrons échangés. - quantité d’électricité Q qui a traversé l’électrolyseur : - Q = I . Δ
t - Q ≈ 0,50 × 45 × 60 - Q ≈ 1350 C ≈ 1,4 × 10 3 C
4)- Établir la relation liant Q et la quantité de matière en protons ayant réagi. - relation liant Q et la quantité de matière en protons ayant réagi : - Q = n (e –
) .
F
- Q = n (H+ ) .
F
5)- En déduire la quantité de matière en protons restant après l’électrolyse, ainsi que le pH de la solution. - quantité de matière en protons restant après l’électrolyse : - - Valeur du pH de la solution : -
6)- Déterminer le volume de gaz formé à la cathode. La pression dans les conditions de cette expérience est P = 1,013 × 10 5 Pa. - Quantité de matière de gaz formé à la cathode : - - Volume molaire : - Volume du gaz : - V = n (H+ ) . Vm ≈ 7,0 × 10 – 3 × 24,4 - V ≈ 0,17 L |
||||||||||||||||||||||||||||||||||
|
On donne la constante des gaz parfaits
R = 8,31 SI. Remarque :
On rappelle qu’en solution aqueuse un proton
H+
donne un ion oxonium
H3O+.
|