|
On étudie la cinétique de la
réaction de décomposition de l’eau oxygénée
H2O2
par
les ions iodure
I –
en
milieu acide.
L’équation-bilan de la réaction s’écrit :
H2O2
+
2
I
–
+ 2
H +
→
2 H2O + I2
On suit l’évolution du système
par spectrophotométrie.
L’absorbance A est liée à la concentration en
diiode [I2]
par une relation que l’on
établira.

I-
Étude
préliminaire
On mesure l’absorbance
A pour des solutions de diiode [I2]
de concentrations connues.
On obtient les mesures suivantes :
|
[I2]mol/L
|
0,0000
|
0,0001
|
0,0005
|
0,001
|
0,002
|
0,004
|
0,006
|
0,008
|
|
A
|
0,0000
|
0,037
|
0,102
|
0,203
|
0,304
|
0,741
|
1,073
|
1,550
|
1)- Représenter
graphiquement A =
f ([I2]).
Échelles :
1 cm
↔ 5
× 10
– 4
mol / L et
1 cm
↔ 0,1 unité d’absorbance.
2)- Pour mesurer
l’absorbance d’une espèce chimique dans une solution, il faut que cette
espèce chimique possède une « propriété » particulière.
Laquelle et
pourquoi ?
3)- Après avoir
rappelé la loi de Beer-Lambert peut-on dire que dans le cas de notre
étude cette loi est vérifiée ? Justifier votre réponse.
4)- Déterminer la
valeur ainsi que la dimension du coefficient de proportionnalité
k
entre A et [I2]
tel que A = k
x
[I2].

II-
Conditions
expérimentales.
On place dans la cuve de mesure
du spectrophotomètre un volume
V0 = 1,0 mL
de
solution d’eau oxygénée de concentration initiale
C0
= 0,080 mol/L.
A l'instant t = 0, on ajoute un volume
V1 = 1,0 mL
de solution acidifiée d'iodure de potassium (K+
+ I
–) de concentration
C1
= 0,060 mol / L
1)- Après avoir
indiqué les couples redox qui interviennent dans la réaction étudiée,
écrire les demi-équations électroniques correspondantes.
2)- Pourquoi
a-t-on acidifié la solution d’iodure de potassium ?
3)- Quel est le
réactif limitant de cette réaction ? Justifier votre réponse.
4)- Déterminer
les concentrations initiales (à t = 0)
en ion iodure I
–
et en eau
oxygénée H2O2
.
5)- Calculer la
valeur de la concentration en diiode en fin de réaction.

III-
Étude
cinétique
On lance la mesure de l’absorbance en fonction du
temps en effectuant une mesure toutes les secondes.
On obtient
l’enregistrement donné en annexe (figure
1) :
1)- Définir la
vitesse volumique de réaction.
2)- Déterminer
l’expression de la vitesse volumique de réaction en fonction
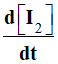 de
puis de de
puis de
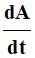 . .
3)- Déterminer la
valeur de la vitesse volumique de réaction à t = 50 s.
Si nécessaire, on
prendra k = 190 SI.
4)- Comment
évolue la vitesse volumique de réaction ? Donner une interprétation
microscopique à ce phénomène.
5)- Après l’avoir
défini, déterminer le temps de demi-réaction.
6)- Cette
réaction s’est déroulée à une température
θ.
Donner l’allure de
la courbe
A = f (t) sur le graphe fourni si elle s’était
déroulée à une température θ’ inférieure à
θ.
|