|
Chim N° 07 :
|
|
|
|
|
IV- Un cas particulier intéressant :
l’autocatalyse. |
|
Matériel : |
Peroxodisulfate de potassium C1 = 0,050 mol / L, iodure de potassium C2 = 0,50 mol / L, solution de sel de Mohr, acide oxalique C1 = 0,10 mol / L, solution de permanganate de potassium C2 = 0,010 mol / L, sulfate ou chlorure de manganèse, acide sulfurique concentré, eau oxygénée, fil de platine, |
1)- Mise en évidence expérimentale.
a)- Expérience 1 : réaction entre les ions iodure et les ions peroxodisulfate :
![]() Bécher
A : on verse,
Bécher
A : on verse,
- 50 mL d’une solution de peroxodisulfate de potassium C1 = 0,050 mol / L,
- 50 mL d’une solution d’iodure de potassium C2 = 0,50 mol / L.
![]() Bécher
B : on verse,
Bécher
B : on verse,
- 50 mL d’une solution de peroxodisulfate de potassium C1 = 0,050 mol / L,
- 50 mL d’une solution d’iodure de potassium C2 = 0,50 mol / L,
- Et 10 mL d’une solution de sel de Mohr (cette solution contient des ions fer II)
► observations :
- On observe le jaunissement ou le brunissement de la solution dans les deux béchers.
- Cela est dû à la formation de diiode qui en présence d’ions iodure donne des ions I3 de couleur jaune-brun.
- Dans le bécher B, on constante que la coloration évolue plus rapidement que dans le bécher B.
- On peut affirmer que la réaction est plus rapide dans le bécher B que dans le bécher A.
- Potentiels d’oxydoréduction des différents couples :
|
S2O8
(aq) / SO4 2
– (aq) |
E01
= 2,01 V |
|
I 2 (aq)
/ I – (aq) |
E02
= 0,54 V |
|
Fe
3+(aq) /
Fe 2+(aq) |
E03
= 0,77 V |
- Réaction dans le bécher A :
|
S2O82 – (aq) + 2
I – (aq) →
2 SO42 – (aq) +
I2 (aq) |
Réaction lente |
- Réactions dans le bécher B :
- Réaction 1 :
|
S2O82 – (aq)
+ 2
Fe
2+(aq)
→ 2 SO42 –
(aq) + 2
Fe
3+(aq)
|
Réaction rapide |
- Réaction 2 :
|
2 I
– (aq) + 2
Fe
3+(aq)
→ I2 (aq)
+ 2
Fe
2+(aq)
|
Réaction rapide |
- Bilan global :
|
S2O82 – (aq) + 2
I – (aq) →
2 SO42 – (aq) +
I2 (aq) |
Réaction
rapide |
- Ici, on a remplacé une réaction lente par deux réactions rapides.
- Les ions fer II ont participé aux réactions 1 et 2, mais ils n’interviennent pas dans le bilan global de la réaction.
- Ils ont été régénérés en fin de réaction.
- On dit que les ions fer II ont catalysé la réaction entre les ions peroxodisulfate et les ions iodure.
- Ils ont accéléré la réaction : l’ion fer II est un catalyseur de la réaction.
- Remarque : on peut aussi catalyser cette réaction avec les ions fer III.
- Un catalyseur est une substance qui accélère une réaction sans entrer dans le bilan de la réaction.
- Catalyser une réaction, c’est augmenter sa vitesse par ajout d’un catalyseur.
- La catalyse est dite homogène lorsque le catalyseur et le mélange réactionnel constituent une seule phase (forment un mélange homogène).
- C’est le cas des gaz et des liquides miscibles.
- Exemple : la dismutation de l’eau oxygénée est catalysée par les ions fer II.
|
|
Fe
2+ |
|
|
|
|
2 H2O2
(aq) |
|
→ |
2 H2O
(ℓ) |
+ O2 (aq) |
- La catalyse est dite hétérogène lorsque le catalyseur et le milieu réactionnel se trouvent dans des phases différentes.
- Exemple : expérience de la lampe sans flamme (on utilise un fil de cuivre chauffé comme catalyseur)
|
|
Cu |
|
|
|
|
2 C2H5OH
+
O2 |
|
→ |
2 CH3CHO |
+ H2O |
- Exemple : dismutation de l’eau oxygénée catalysée par un fil de platine.
|
|
Pt |
|
|
|
|
2 H2O2
(aq) |
|
→ |
2 H2O (ℓ) |
+ O2 (aq) |
- Une réaction est autocatalysée lorsque l’un des produits de la réaction est un catalyseur de cette réaction.
- Remarque : en toute rigueur, le terme autocatalyse est un terme impropre car le catalyseur apparaît dans le bilan de la réaction.
- Exemple :
- Oxydation de l’acide éthanedioïque par les ions permanganate. Réaction qui est étudiée en détail en fin de chapitre.
III- Caractères généraux de la catalyse.
- Un catalyseur ne permet pas à une réaction non naturelle de se produire.
- Un catalyseur ne peut accélérer qu’une réaction naturelle.
- Lorsqu’une réaction est limitée, le catalyseur permet d’arriver plus vite à l’état d’équilibre mais il ne déplace pas l’équilibre.
- Le catalyseur n’apparaît pas dans le bilan de la réaction. Il participe à la réaction mais il est régénéré en fin de réaction.
- Un système cinétiquement inerte peut évoluer très rapidement en présence d’un catalyseur.
- La sélectivité d’un catalyseur est la propriété de favoriser une réaction plutôt qu’une autre lorsque plusieurs réactions sont possibles avec les mêmes réactifs.
- Un catalyseur est spécifique à une réaction chimique.
- Un catalyseur permet d’éviter certaines réactions parasites.
- Il permet de travailler dans des conditions de température et de pression plus faibles.
- Il peut permettre de diminuer les coûts de production.
IV- Un cas particulier intéressant : l’autocatalyse.
![]() on verse,
on verse,
- 40 mL d’une solution d’acide oxalique C1 = 0,10 mol / L,
- 30 mL d’une solution de permanganate de potassium C2 = 0,010 mol / L.
- 2 mL d’acide sulfurique concentré.
![]() on verse,
on verse,
- 40 mL d’une solution d’acide oxalique C1 = 0,10 mol / L,
- 30 mL d’une solution de permanganate de potassium C2 = 0,010 mol / L.
- 2 mL d’acide sulfurique concentré,
- Et une spatule de sulfate ou de chlorure de manganèse.
► Observations :
- La réaction évolue plus rapidement dans le bécher B que dans le bécher A.
- La coloration violette disparaît plus rapidement.
- Le sulfate de manganèse accélère la réaction entre le permanganate de potassium et l’acide oxalique.
- C’est un catalyseur de cette réaction.
-
Ce sont les ions manganèse Mn2+ (incolore)
qui catalyse la réaction.
- Potentiels d’oxydoréduction des différents couples :
|
MnO4
– (aq)
/ Mn2+(aq) |
E01
= 1,51 V |
|
CO2
(aq) / H2C2O4
(aq) |
E02
= – 0,49 V |
- Demi-équations électroniques et équation bilan de la réaction :
|
(MnO4
– (aq) + 8
H
+(aq) + 5
e
–
= Mn2+(aq) + 4
H2O
(ℓ)
) x
2 |
|
( H2C2O4
(aq) = CO2
(aq) +
2
H +(aq) + 2
e
–
) x
5 |
|
2
MnO4
– (aq) + 5
H2C2O4
(aq) + 6
H
+(aq)
→ 2 Mn2+(aq) +
10 CO2
(aq)
+
8 H2O
(ℓ) |
- On remarque que la réaction génère des ions manganèse Mn2+ (aq), or ces ions catalysent la réaction.
- On dit que la réaction est « autocatalysée ».
- Lors d’une autocatalyse, deux facteurs agissent en sens inverse sur la cinétique de la réaction :
- L’augmentation de la concentration du produit catalyseur qui accélère la réaction.
- La diminution de la concentration des réactifs qui ralentit la réaction.
- Au début, la réaction s’accélère car l’effet catalytique est important et il y a beaucoup de réactifs.
- Puis la vitesse diminue à cause de la diminution de la concentration des réactifs.
-
La vitesse de disparition de l’ion permanganate
MnO4
– (aq)
est à chaque instant donnée par la relation :
-
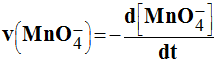
- Si cette vitesse est maximale au temps t1, alors :
-
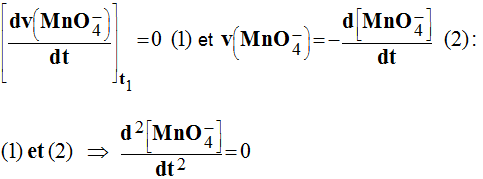
-
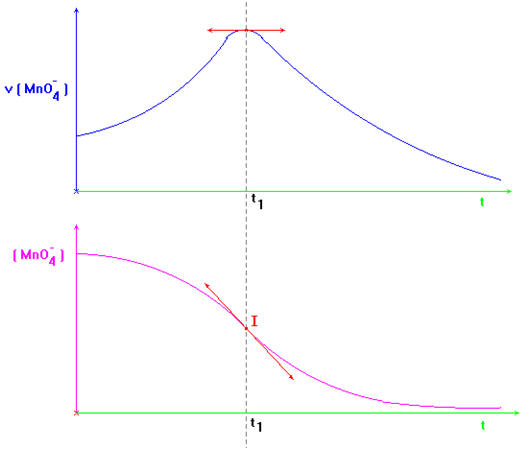
La courbe : [MnO4
–
] =
f (t)
admet un point d’inflexion à l’instant t1
(instant ou la vitesse est maximale.

V- Applications. Exercices 5, 7 et 13 pages 66, 67, 68, 69.
3)- Exercice 13 pages 68 et 69.
|
|
|
|