|
Chim
N° 02 :
et une base forte
|
|
|
|
- Un acide, selon Brönsted, est une espèce chimique capable de céder au moins un proton H+.
- Écriture symbolique : on note l’acide AH :
- En conséquence : AH → H+ + A–
- Exemples :
|
HCl → H+
+ Cl – |
|
NH4+
→ H+ + NH3 |
|
H2O
→ H+ + OH – |
- Un acide peut être une molécule ou un ion.
- Une base, selon Brönsted, est une espèce chimique capable de capter au moins un proton H+.
- Écriture symbolique : on note la base B :
- En conséquence :
B + H+
→ BH+
- Exemples :
|
NH3
+ H+ → NH4+ |
|
H2O
+ H+ → H3O+
|
|
OH– + H+
→ H2O |
- Une base peut être une molécule ou un ion.
- Couples acide / base conjuguée.
- À l’acide AH correspond la base A–.
- Car : AH → H+ + A– et A– + H+ → AH
- On peut utiliser le schéma l’écriture suivante :
-
AH = H+
+ A–
- Acide = base + H+
- AH / A– Cette écriture forme un couple acide/base conjuguée.
2)- Les acides forts dans l’eau.
- En solution aqueuse, un acide est une espèce chimique capable de céder 1 proton au solvant.
- Un acide fort est un acide dont la réaction avec l’eau est totale.
- Si AH est un acide fort dans l’eau alors :
-
AH +
H2O
→
A–
+ H3O+
|
Espèces présentes : |
Le solvant : H2O |
|
Les espèces majoritaires : A– et H3O+ |
|
|
L’espèce ultra minoritaire : OH– |
|
|
Il ne reste plus de molécule AH |
- Les espèces en solution sont classées en majoritaires, minoritaires et ultra minoritaires.
- Convention : [maj] ≥ 100 [min] ≥ 10000 [ultramin]
- Conséquence : H2O et H3O+ sont les seuls acides présents dans une solution aqueuse d’acide fort.
- Exemples d’acides forts dans l’eau :
- L’acide chlorhydrique (H3O+ + Cl–), l’acide sulfurique (H3O+ + HSO4–),
- L’acide nitrique (H3O+ + NO3–), l’acide perchlorique (H3O+ + ClO4–),…
► Application :
- Le chlorure d’hydrogène est un gaz très soluble dans l’eau. La réaction avec l’eau est totale.
- Écrire l’équation bilan de la réaction.
HCl + H2O → H+
+ Cl –
- Quelles sont les espèces présentes dans la solution ? associer un qualificatif à chaque espèce.
|
Espèces présentes : |
Le solvant : H2O |
|
Les espèces majoritaires : Cl – et H3O+ |
|
|
L’espèce ultra minoritaire : OH – |
|
|
Il ne reste plus de molécule HCl |
- Comment peut-on qualifier cette solution ? Quelle formule peut-on lui donner ? quel qualificatif peut-on lui associer ?
- Solution acide – acide chlorhydrique : (Cl – + H3O+) : Acide fort.
- On
dissout 1,0
×
10 –
2 mole
de HCl dans un
litre d’eau. Quel est le pH
de la solution obtenue ?
- pH = 2,0.
3)- Les bases fortes dans l’eau.
- En solution aqueuse, une base est une espèce chimique capable de capter 1 proton au solvant.
- Une base forte dans l’eau est une base dont la réaction avec l’eau est totale.
- Si B est une base forte dans l’eau alors :
B + H2O → BH+
+ OH–
|
Espèces présentes : |
Le solvant : H2O |
|
Les espèces majoritaires : BH+ et OH– |
|
|
L’espèce ultra minoritaire : H3O+ |
- Il ne reste plus de molécule B dans l’eau.
- Conséquence : H2O et OH–sont les seules bases présentes dans une solution aqueuse de base forte.
- Exemples de bases fortes :
- La solution aqueuse d’hydroxyde de sodium ou soude, la solution aqueuse d’hydroxyde de potassium, L’ion éthanolate en solution aqueuse.
- Donner les équations bilans des réactions de ces bases avec l’eau.
NaOH + H2O → Na+, H2O + OH–
- Cela revient à la dissolution d’un composé ionique dans l’eau que l’on peut écrire plus simplement :
|
|
eau |
|
|
NaOH + H2O |
→ |
Na+ + OH– |
- formule de la soude : (Na+ + OH–)
- Autres exemples :
|
|
eau |
|
|
KOH + H2O |
→ |
K+ + OH– |
|
|
eau |
|
|
CH3CH2O– + H2O |
→ |
CH3CH2OH + OH– |
► Application 1.
![]() On dilue 100 fois une solution d'acide nitrique de
pH = 2,80.
On dilue 100 fois une solution d'acide nitrique de
pH = 2,80.
![]() L'acide nitrique est un acide fort.
L'acide nitrique est un acide fort.
![]() Comment procède-t-on pour effectuer cette dilution ?
Comment procède-t-on pour effectuer cette dilution ?
![]() Déterminer la valeur du
pH de la solution après dilution.
Déterminer la valeur du
pH de la solution après dilution.
II- Réaction entre un acide fort et une base forte.
1)- Étude quantitative de la réaction entre l’acide
chlorhydrique et la soude.
► Application 2.
- On possède une solution acide SA (acide chlorhydrique) et une solution basique SB (la soude ou solution aqueuse d'hydroxyde de sodium).
|
|
CA =
0,10 mol / L |
|
CB = 0,10 mol / L |
|
SA |
VA =
10 mL |
SB |
VB = 5 mL |
|
|
pH = 1,10 |
|
pH = 12,9 |
- On mélange les deux solutions et on ajoute un volume Ve = 10 mL d'eau, on obtient la solution S.
- On mesure le pH de la solution S : pH = 1,70.
- Donner les espèces présentes dans la solution SA et déterminer les quantités de matières des espèces présentes.
- Donner les espèces présentes dans la solution SB et déterminer les quantités de matières des espèces présentes.
- Donner les espèces présentes dans la solution S et déterminer les quantités de matières des espèces présentes.
- Compléter le tableau :
|
|
n (H3O+) |
n (OH–) |
n (Cl –) |
n (Na+) |
|
Avant mélange |
|
|
|
|
|
Après mélange |
|
|
|
|
► Solution :
- Espèces présentes dans la solution SA et déterminer les quantités de matières des espèces présentes :
![]() Solution d’acide chlorhydrique (acide fort) :
Solution d’acide chlorhydrique (acide fort) :
|
Espèces présentes : |
Le solvant : H2O |
|
Les espèces majoritaires : Cl– et H3O+ |
|
|
L’espèce ultra minoritaire : OH– |
|
|
Il ne reste plus de molécule HCl |
- Quantité de matière d’ions hydronium :
- pH = 1,10
- Par définition :
- pH
= – log [H3O+]
cette relation est équivalente à [H3O+]
= 10 – pH mol.L–1
-
[H3O+]
= 10 – 1,10 mol.L–1
-
[H3O+]
≈ 7,9
× 10–2 mol / L.
-
n (H3O+)
= [H3O+]
. VA
-
n (H3O+)
≈ 7,9
× 10
–2 x
10 x 10 – 3
-
n (H3O+)
≈ 7,9
×10 –4 mol
- Quantité
de matière d’ions chlorure :
-
n (Cl –)
= CA . VA
≈ 0,10
× 10 x
10 – 3
-
n (Cl –)
= CA . VA
≈ 1,0
× 10 – 3 mol
- Quantité
de matière d’ions hydroxyde :
-
pKe = 14 =>
[OH –]
= 10 pH –
pKe mol.L–1
-
[OH –]
= 10
1,10 –
14 mol.L–1
-
[OH –]
≈ 1,3
× 10 –13 mol.L–1
- n
(OH –) = [OH –] . VA
-
n (OH
–) ≈ 1,3
× 10 –13 ×
10
× 10 – 3
-
n (OH
–) ≈ 1,3
× 10 –15 mol
![]() Solution de soude (base forte)
Solution de soude (base forte)
|
Espèces présentes : |
Le solvant : H2O |
|
Les espèces majoritaires : Na+ et OH– |
|
|
L’espèce ultra minoritaire : H3O+ |
- Quantité de matière d’ions hydronium :
- pH = 12,9
- Par définition :
- pH
= – log [H3O+]
cette relation est équivalente à [H3O+]
= 10 – pH mol.L–1
-
[H3O+] =
10 – 12,9 mol.L–1
-
[H3O+]
≈ 1,3
× 10
–13 mol / L.
-
n (H3O+)
= [H3O+]
. VB
-
n (H3O+)
≈ 1,3
× 10 –13 ×
10
× 10 – 3
-
n (H3O+)
≈ 1,3
× 10 –15 mol
- Quantité
de matière d’ions hydroxyde :
-
pKe = 14 => [OH–] =
10 pH – pKe mol.L–1
-
[OH –] =
10 12,9
– 14 mol.L–1
-
[OH –] ≈ 7,9
× 10 –2 mol.L–1
- n
(OH –) = [OH–] . VB
-
n (OH
–) ≈ 7,9
× 10 –2
× 10
× 10 – 3
-
n (OH
–) ≈ 7,9
× 10 –4 mol
- Quantité de matière d’ions sodium
-
n (Na+)
= CA . VA
≈ 0,10
× 10
× 10 – 3
-
n (Na+)
= CA . VA
≈ 1,0
× 10 – 3 mol
![]() Avant mélange :
Avant mélange :
|
|
n (H3O+) |
n (OH –) |
n (Cl –)
|
n (Na+) |
|
Avant mélange |
7,9 × 10 –4 mol |
7,9 × 10 –4 mol |
1,0 × 10 – 3 mol |
1,0 × 10 – 3 mol |
|
Après mélange |
|
|
|
|
![]() On mélange les deux solutions :
On mélange les deux solutions :
- Quantité de matière d’ions hydronium :
- pH = 1,70
- Par définition :
- pH
= – log [H3O+]
cette relation est équivalente à [H3O+]
= 10 – pH mol.L–1
-
[H3O+]
= 10 – 1,70 mol.L–1
-
[H3O+]
≈ 2,0
× 10
–2 mol / L.
-
n (H3O+)
= [H3O+]
. (VA + VB
+ Ve)
-
n (H3O+)
≈ 2,0
× 10 –2 ×
25
× 10 – 3
-
n (H3O+)
≈ 5,0
× 10 –4 mol
- Quantité
de matière d’ions hydroxyde :
-
pKe = 14 => [OH
–] = 10 pH – pKe mol.L–1
-
[OH –] =
10 1,7
– 14 mol.L–1
-
[OH –] ≈ 5,0
× 10–13 mol.L–1
-
n (OH –) = [OH –] . (VA
+ VB + Ve)
-
n (OH
–) ≈ 5,0
× 10 –13
× 25
× 10 – 3
-
n (OH
–) ≈ 1,3
× 10 –14 mol
- Quantité
de matière d’ions sodium
- Elle est
inchangée : n (Na+)
= CA . VA
≈ 1,0
× 10 – 3 mol
- Ce qui change, c’est la concentration des ions sodium.
- Quantité de matière d’ions chlorure :
- Elle est
inchangée : n (Cl
–) = CA
. VA
≈ 1,0
× 10 – 3 mol
- Ce qui change, c’est la concentration des ions chlorure.
2)- Conséquences et conclusions.
|
|
n (H3O+) |
n (OH–) |
n (Cl–) |
n (Na+) |
|
Avant mélange |
7,9 × 10 –4 mol |
7,9 × 10 –4 mol |
1,0 × 10 – 3 mol |
1,0 × 10 – 3 mol |
|
Après mélange |
5,0 × 10 –4 mol |
1,3 × 10 –14 mol |
1,0 × 10 – 3 mol |
1,0 × 10 – 3 mol |
- Les ions
hydroxyde OH – réagissent quantitativement avec les ions
hydronium H3O+.
- 1,3
× 10
–14 mol << 5,0
× 10 –4 mol. Les ions hydroxyde sont ultra
minoritaires dans le mélange.
-
L’équation bilan de la réaction : H3O+ +
OH – →
2 H2O
- C’est la
réaction inverse de la réaction d’autoprotolyse de l’eau.
- C’est une
réaction : totale, rapide exothermique.
- Elle
dégage Qr
= -55,8 kJ / mol.
- Les ions
chlorure et les ions sodium ne participent pas à la réaction :
- Ions
indifférents ou ions spectateurs.
- Il y a un
transfert de proton de l’ion hydronium H3O+ vers
l’ion hydroxyde OH –.
- C’est une
réaction acido-basique.
III- Étude pH-métrique de la réaction entre un acide fort et une base forte (TP chimie N° 2).
1)- Étude du graphe
pH = f (VB).
a)- Définition de l’équivalence :
![]() il y a équivalence lorsque les réactifs ont été mélangés dans les
proportions stœchiométriques de l’équation de la réaction considérée.
il y a équivalence lorsque les réactifs ont été mélangés dans les
proportions stœchiométriques de l’équation de la réaction considérée.
- Équation
bilan de la réaction : H3O+ +
OH – →
2 H2O
- À l’équivalence :
|
n
(OH –)ajoutés à l’équivalence =
n (H3O+)
initialement présents |
- Or :
n (H3O+)initialement
présents = CA . VA
- Et
n (OH–)ajoutés
à l’équivalence = CB . VBE
- À
l’équivalence :
|
CA
. VA =
CB . VBE |
b)- pH à l’équivalence : à l’équivalence :
-
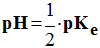 à 25 °C,
pH = 7.
à 25 °C,
pH = 7.
- Remarque : ceci n’est vrai que pour la réaction entre un acide fort et une base forte.
► Application 3 : pH à l'équivalence.
- On fait
réagir une solution d'hydroxyde de sodium de concentration CB
= 5,0
× 10
–3 mol / L
avec un volume VA =
10 mL d'acide chlorhydrique de concentration CA
= 1,0
× 10 –2 mol / L.
- Écrire l'équation bilan de la réaction chimique qui se produit. Quels sont les caractéristiques de cette réaction ?
-
Déterminer le volume VBE de
base versée à l'équivalence.
- Déterminer la valeur du pH de la solution obtenue à l'équivalence.
- Quelles sont les caractéristiques de cette solution ?
► Solution :
- Équation bilan de la réaction chimique :
H3O+ +
OH –
→
2
H2O
- C’est une réaction quasi-totale, rapide.
- Volume VBE de base versée à l'équivalence :
- Il y a équivalence lorsque les réactifs ont été mélangés dans les proportions stœchiométriques de l’équation de la réaction considérée.
- À l’équivalence :
|
CA
. VA =
CB . VBE |
-
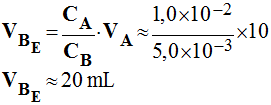
- Valeur du pH de la solution à l’équivalence :
-
![]() à 25 °C,
pH = 7.
à 25 °C,
pH = 7.
- Remarque : ceci n’est vrai que pour la réaction entre un acide fort et une base forte.
|
|
[H3O+] |
[OH–] |
[Cl–] |
[Na+] |
|
À l’équivalence
mol / L |
1,0 × 10–7 |
1,0 × 10–7 |
3,3 × 10 – 3 |
3,3 × 10 – 3 |
- On est en présence d’une solution de chlorure de sodium. Solution neutre.
c)- Détermination graphique du point d’équivalence E.
- Le point d’équivalence, noté E, est le point de la courbe pH = f (VB) tel que :
|
VB
= VBE |
|
pH = 7 |
- C’est le point d’inflexion de la courbe pH = f (VB).
-
On peut déterminer les coordonnées de ce point par la méthode des
tangentes.
|
Méthode des tangentes : Elle permet par une méthode graphique de déterminer les coordonnées du point d'équivalence E. On trace deux tangentes à la courbe pH = f (VB), parallèles et situées de part et d'autre du point d'équivalence (point d'inflexion de la courbe) et suffisamment proche de l'équivalence. On trace ensuite la parallèle à ces deux tangentes, équidistantes de celles-ci. Son point d'intersection avec la courbe définit le point d'équivalence E. |
Cliquer
sur l'image pour l'agra
d)- Influence de la concentration.
- Si l’on diminue les valeurs des concentrations en les gardant égales, à l’équivalence, le pH est toujours égal à 7 mais le saut de pH diminue.
- Doser une solution aqueuse d’acide fort ou de base forte, c’est déterminer sa concentration.
- On réalise une réaction acido-basique (réaction rapide, totale) et on détermine la fin du dosage c’est-à-dire l’équivalence acido-basique.
2)- Méthode 1 : utilisation de la courbe
pH= f (Vréactif titrant).
- Pour déterminer les coordonnées du point E, on utilise la méthode des tangentes ou la fonction dérivée.
- On détermine la valeur de VBE et on en déduit la valeur de CA.
3)- Méthode colorimétrique : emploi d’un indicateur
coloré.
- Ce sont des indicateurs dont la teinte dépend du pH de la solution.
- Ils possèdent une zone de virage.
|
|
3,1 |
4,4 |
||
|
Hélianthine |
rouge |
Zone de
Virage
orange |
Jaune |
|
|
|
6,0 |
7,6 |
||
|
B.B.T |
jaune |
Zone de Virage
vert |
Bleu |
|
|
|
8,2 |
10 |
||
|
Phénolphtaléine |
Incolore |
Zone de virage
Rose très pâle |
Rose |
|
- Un indicateur coloré convient pour un dosage acido-basique si sa zone de virage contient le pH du point équivalent E.
Cliquer
sur l'image pour l'agra
V- Applications. Exercices : 10, 11, 15 pages 117 – 118.