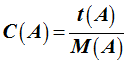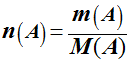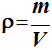|
QCM N° 16 a |
et la concentration molaire. |
|
|
|
|
QCM N°16 a
La quantité de matière :
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’unité de quantité de matière
est notée : |
mol. |
mol–1. |
mole. |
A |
|
2 |
Une mole d’atomes contient : |
6,02 × 10–23 atome. |
6,02 × 103 atomes. |
6,02 × 1023 atomes. |
C |
|
3 |
Une masse molaire s’exprime
en : |
mol . g–1 |
g . mol –1 |
g / mol –1 |
B |
|
4 |
La masse molaire du camphre (C10H16O) est égale à : |
M (C) + M (H) + M (O) |
M (C) + 10 M (H) + 16 M (O) |
10 M (C) + 16 M (H) + M (O) |
C |
|
5 |
La masse molaire ionique de
CO32– est égale à : |
M (C) + 3 M
(O) |
M (C) + M (O) |
2 M (C) + 3 M (O) |
A |
|
6 |
La concentration molaire C en soluté A d’une solution de volume Vsolution
est : |
|
|
|
A |
|
7 |
La relation qui lie la concentration molaire C (A) en soluté A et la concentration massique t (A)
est : |
|
|
|
AC |
|
8 |
La quantité de soufre présente dans 3,2 g de soufre est : On donne : M (S) = 32,1 g . mol
–1 |
0,32 mol |
0,10 mol |
1,0 mol |
B |
|
9 |
La quantité de matière d’eau présente dans 18 mL d’eau est : On donne :
M
(H2O)
= 18 g . mol–1
ρ
(H2O) = 1,0
g . mL–1 |
0,10 mol |
10 mol |
1,0 mol |
C |
|
10 |
Pour préparer 100 mL d’une solution de concentration molaire 0,100 mol . L–1 en maltose, la quantité de matière de maltose à
dissoudre est égale à : |
10,0 mol |
1,00 mol |
1,00
× 10–2 mol |
C |
►
La mole.
-
Les entités chimiques comme, les
atomes, les molécules et les ions, se comptent aussi par paquet.
-
On appelle mole un paquet
d’entités chimiques.
-
La mole est la réunion d'un
nombre déterminé d’entités chimiques toutes identiques.
-
Définition : La mole est la
quantité de matière d'un système contenant autant d'entités
élémentaires qu'il y a d'atomes dans
►
La constante d’Avogadro
NA.
-
Le nombre
NA
est défini par la relation suivante :
-
![]()
-
Le nombre
NA
représente le nombre d’entités élémentaires par mol, on
l’exprime en
mol–1.
-
Des mesures récentes indiquent
qu’il y a : 6,022137
× 1023
atomes de carbone 12 dans
- On arrondit cette valeur.
-
On écrit :
-
NA
≈ 6,02
× 1023 mol–1
-
Conséquence : une mole, est un
paquet de 6,02
× 1023 entités
chimiques identiques.
►
La masse molaire.
-
Définition générale.
-
La masse molaire d’une espèce
chimique est la masse d’une mole de cette espèce chimique.
- On symbolise la masse molaire par M.
- La masse molaire s’exprime en g / mol ou g .
mol– 1
-
Masse molaire atomique :
-
La masse molaire atomique est la
masse d'une mole d'atomes de l'espèce considérée.
-
La masse molaire moléculaire.
-
La masse molaire moléculaire est
la masse d'une mole de molécules de l'espèce considérée.
-
La masse molaire moléculaire
s'obtient en faisant la somme des masses molaires atomiques des
atomes qui constituent la molécule.
-
Masse molaire ionique.
-
La masse molaire ionique est la
masse d'une mole d'ions de l'espèce considérée.
-
On peut négliger la masse des
électrons devant la masse du noyau d'un atome.
-
La masse molaire d'un ion
monoatomique est pratiquement égale à celle de l'atome
correspondant.
►
Quantité de matière
n de l’espèce
chimique A :
-
Écriture symbolique :
|
n
(A) |
Quantité de matière de l'espèce chimique
considérée A en
mol |
|
M (A) |
Masse molaire de l'espèce chimique considérée en
g / mol |
|
m (A) |
Masse de l'espèce chimique considérée en g |
|
Relations : |
ou
|
►
La masse volumique
ρ .
-
La masse volumique d’une espèce
chimique est égale au quotient de sa masse par son volume.
-
On écrit :
|
|
m
:
Masse de l'échantillon considéré en kg
V
:
Volume occupé par l’échantillon en m3
ρ :
Masse volumique de l’échantillon en kg / m3
|
-
Autres unités : kg / L ou kg / dm3
; g /
cm3
ou g
/ mL.
►
La densité d.
-
La densité des liquides et des
solides se mesure par rapport à l’eau.
-
La
densité des gaz se mesure par rapport à l’air.
-
-
Relation : on écrit :
|
|
La densité est un nombre
qui
s’exprime sans unité. |
►
Concentration massique
Cm ou teneur
massique t (A) :
-
La concentration massique d’une
espèce chimique est la masse de cette espèce chimique dissoute
dans un litre de solution.
-
Relation : 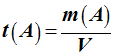
-
t
(A)
concentration massique en soluté apporté en g / L
-
m
(A) masse
de soluté apporté en g.
-
V =
V
sol
volume de la solution aqueuse obtenue en L.
►
Concentration molaire
C :
-
La concentration molaire d’une
espèce chimique en solution est la quantité de matière de soluté
présente dans un litre de solution.
-
Relation : 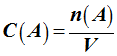
-
C
(A)
concentration molaire en soluté apporté en mol / L
-
n
(A)
quantité de matière de soluté apporté en mol.
-
V =
V
sol
volume de la solution aqueuse obtenue en L.
►
Les différentes relations :
-
On en
déduit la relation liant la concentration massique et la
concentration molaire.
-
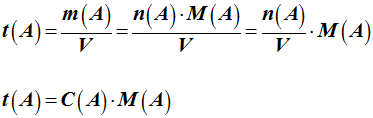
-
ou
-