|
La classification périodique des éléments chimiques de l'Univers. |
|
|
Classification périodique des éléments chimiques de
l’Univers :
Pour chaque question, indiquer la (ou les) bonne(s)
réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La seule formule électronique correcte est : |
K2L9M1. |
K3L8M1. |
K2L8M2. |
C |
|
2 |
Un ion de formule électronique K2L8M8
possède : |
2 électrons externes. |
18 électrons externes. |
8 électrons externes. |
C |
|
3 |
Un atome possédant 9 électrons a : |
1 électron externe. |
7 électrons externes. |
9 électrons externes. |
B |
|
4 |
Un atome de formule électronique K2 L1 tend à respecter la règle : |
De l’OCTET. |
Du DUET. |
De l’OCTAVE. |
B |
|
5 |
Un atome de formule électronique K2 L7 : |
tend à respecter la règle de l’OCTET. |
tend à respecter la règle du DUET |
Ne forme pas
d’ions. |
A |
|
6 |
Pour obtenir la formule électronique d’un gaz noble, un atome de magnésium Mg de formule électronique K2L8M2
peut former : |
Le cation Mg2+. |
L’atome
Ne. |
L’anion
Mg2–. |
A |
|
7 |
Pour obtenir la formule d’un gaz noble, un atome de chlore de formule électronique
K2L8M7
peut former : |
Le cation Cl+. |
L’anion Cl–. |
Le cation
Cl7+. |
B |
|
8 |
Dans la classification périodique. Les éléments sont rangés par :
|
Ordre alphabétique. |
Numéro atomique croissant. |
Masse atomique croissante. |
B |
|
9 |
Les atomes de formules K2L6 et K2L3 appartiennent à la même :
|
Période de la classification. |
Colonne de la classification. |
Famille chimique. |
A |
|
10 |
Les gaz nobles : |
Possèdent tous un octet d’électrons externes. |
Appartiennent à la colonne 18 de la classification périodique. |
Sont très stables. |
BC |
|
11 |
Tous les atomes des éléments de la colonne 1 de la classification : |
Possède 1 électron
externe. |
Appartiennent à la famille des alcalins.
|
Forment des ions de formule
X+. |
AC |
|
12 |
Un atome X d’un élément chimique de la colonne 13 de la
classification : |
Forme un anion X3–. |
Forme un cation
X3+. |
Forme un cation
X+. |
B |
►
Règles de remplissage.
-
Principe de Pauli :
-
chaque couche ne
peut contenir qu’un nombre limité d’électrons.
-
La couche de rang
n
ne peut contenir que
2 n2 électrons.
-
Ainsi la couche
K
ne peut contenir au plus que : 2 électrons.
-
La couche
L, 8
électrons,
-
Et la couche
M,
18 électrons (en seconde, on se limite à 8 électrons sur la
couche M).
-
Les électrons de
l’atome remplissent progressivement les différentes couches
électroniques.
-
Une couche électronique est
saturée lorsqu’elle contient son nombre maximal d’électrons.
-
Les électrons se
placent d’abord dans la couche K,
-
Puis quand celle-ci est
saturée à 2 électrons, ils remplissent la couche
L.
-
Quand la couche
L
est saturée à 8 électrons, ils remplissent la couche
M.
-
L’état de l’atome
obtenu en utilisant ce principe de remplissage est appelé :
l’état fondamental.
►
Structure électronique d’un atome
ou d’un ion.
-
Pour donner la structure
électronique d’un atome, il faut répartir ses électrons sur les
couches K,
L,
M.
-
Pour l’ion :
K2
L8
M8, la couche externe est la couche
L, elle
comprend 8 électrons.
- Remarque : ce sont les électrons de la couche électronique externe qui déterminent la construction des édifices chimiques.
- Ils sont responsables de la
réactivité chimique d’un élément.
-
Pour l’atome possédant 9
électrons : sa structure électronique est :
K2
L7.
-
Il possède 7 électrons sur sa
couche électronique externe.
►
Règles du
DUET
et de
OCTET.
-
Au cours des transformations
chimiques, les atomes tendent à acquérir la structure
électronique du gaz rare de numéro atomique le plus proche :
-
Soit
2
électrons sur la couche électronique externe lorsque
ce gaz rare est Hélium c’est la règle du
DUET.
-
Soit
8
électrons sur la couche électroniques externe, c’est
la règle de l’OCTET.
-
Ils acquièrent de ce fait une
stabilité maximale.
-
Pour satisfaire à ces règles, les
atomes disposent de 2 moyens :
-
Soit par un transfert d’électrons
entre deux atomes différents pour donner des ions,
-
Soit par la mise en commun
d’électrons entre différents atomes pour donner des molécules.
-
L’atome de structure électronique
K2
L1 aura
tendance à perdre 1 électron de sa couche électronique externe
et respecter ainsi la règle du DUET.
-
L’atome de structure électronique
K2
L7 aura
tendance à gagner 1 électron et respecter ainsi la règle de l’OCTET.
►
L’atome de magnésium :
-
L’atome de magnésium
Mg de
formule électronique K2L8M2
peut former le cation
Mg2+.
-
L’élément magnésium est situé
dans la colonne
2.
L’atome de magnésium possède
2
e– sur
sa couche électronique externe.
-
L’ion monoatomique correspondant
est l’ion magnésium Mg2+ : il provient d’un atome de magnésium ayant
perdu 2
e–.
- Suite à la perte de deux électrons sur la couche électronique externe (couche M),
- il acquiert ainsi la structure électronique du gaz rare, ici le néon, Ne.
- Il respecte la règle de l’OCTET.
►
Atome de chlore :
-
L’atome de chlore
Cl de
formule électronique K2L8M7
peut former l’anion Cl–.
-
L’ion monoatomique correspondant
provient d’un atome de chlore ayant gagné 1 électron.
- Suite au gain de cet électron, il acquiert la structure électronique du gaz rare qui le suit dans la classification périodique (Argon, Ar).
- Il respecte la
règle de l’OCTET.
►
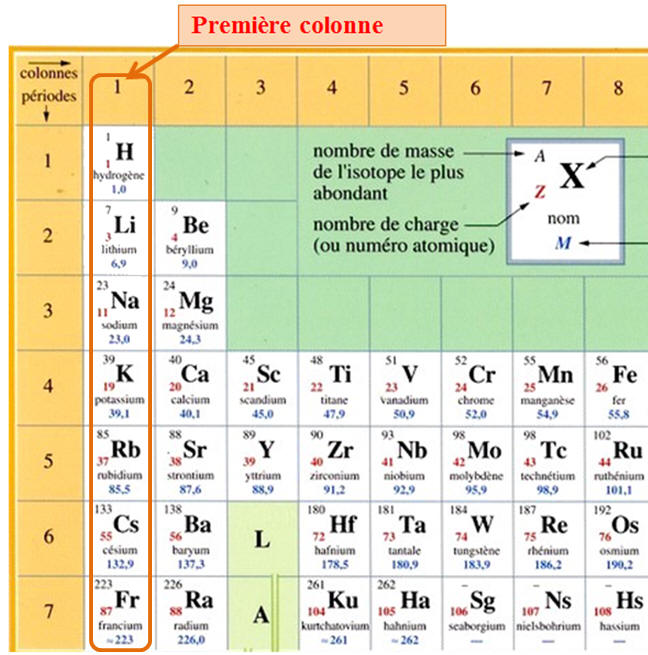
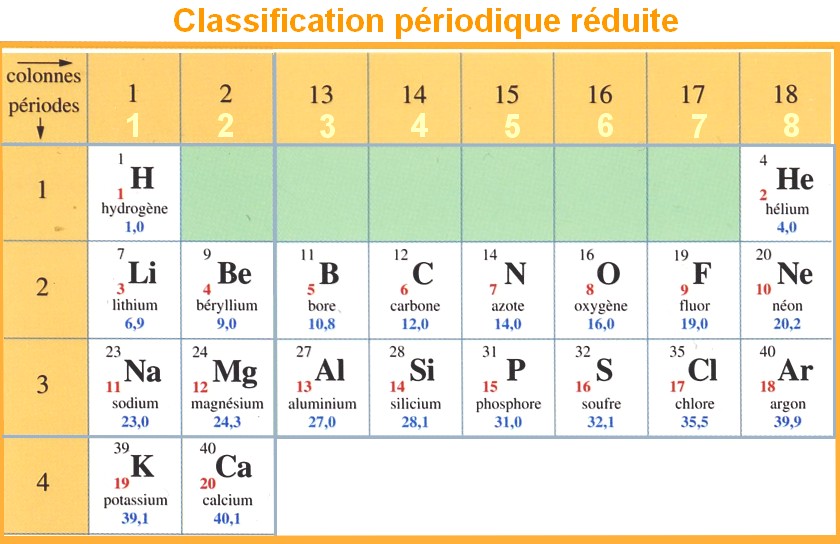
La classification périodique :
-
La classification périodique
comporte 18 colonnes et 7 lignes ou périodes.
-
Les éléments sont classés par
numéro atomique Z croissant.
-
On retrouve dans la
classification périodique le remplissage progressif des couches
électroniques.
-
Les éléments dont les atomes ont
le même nombre d’électrons sur la couche électronique externe
sont disposés dans une même colonne et constituent une famille
chimique.
-
Les éléments chimiques d’une même
famille possèdent des propriétés chimiques voisines.
►
La deuxième période :
- La deuxième période est constituée de huit éléments (lithium, béryllium – 10 cases vides – bore, carbone, azote, oxygène, fluor et néon).
- Elle correspond
au remplissage de la couche L.
►
La famille des gaz nobles.
-
Ce sont les éléments de la
dernière colonne (18ième colonne).
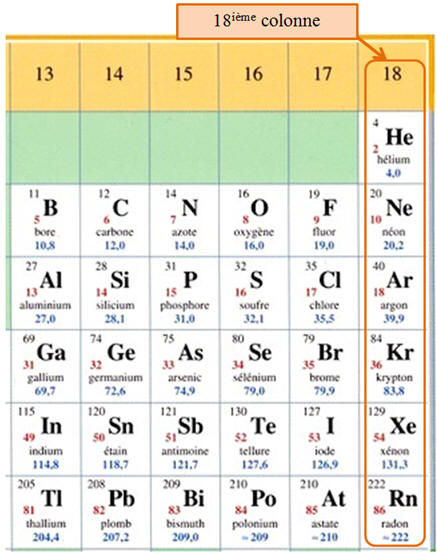
-
L’Hélium mis à part, ils
possèdent une structure externe à huit électrons appelée octet
d’électrons.
|
Z |
Famille des
gaz rares |
Structure électronique La couche électronique externe apparaît en
rouge |
|
2 |
He (Hélium) |
K (2) |
|
10 |
Ne (Néon) |
K (2)
L
(8) |
|
18 |
Ar (Argon) |
K (2) L (8)
M (8) |
|
36 |
Kr (Krypton) |
K (2) L (8)
M
(18)
N (8) |
- Ils possèdent une grande stabilité chimique.
- Ce sont des gaz monoatomiques, on les
appelle les gaz rares.
►
La famille des métaux alcalins.
-
À l’exception de l’hydrogène, les
éléments de la première colonne constituent le groupe des
alcalins.
- Ils ont la même structure électronique externe.
- Il possède 1 électron sur la couche
électronique externe.
|
Z |
Famille des
alcalins |
Structure
électronique La couche
électronique externe apparaît en rouge |
|
3 |
Li
(Lithium) |
K (2)
L
(1) |
|
11 |
Na
(Sodium) |
K (2)
L (8)
M (1) |
|
19 |
K
(Potassium) |
K (2)
L (8)
M
(8)
N (1) |
|
37 |
Rb
(Rubidium) |
K (2)
L (8)
M
(18)
N (8)
O (1) |
►
Charge de quelques ions
monoatomiques.
-
Pour respecter la règle du DUET
ou de l’OCTET, les atomes peuvent gagner ou perdre des électrons
-
La charge des ions monoatomique
se déduit de leur place dans la classification périodique.
- Les atomes des colonnes 1, 2, 13 de la classification ont 1, 2, 3 électrons sur leurs couches électroniques externes.
- Ils
peuvent les perdre pour donner des cations de formule :
-
M+ ;
M2+ ;
M3+.
-
Remarque :
-
En perdant
x électrons
pour acquérir une structure électronique externe en DUET ou en
OCTET, un atome A donne un cation
Ax+.
-
En gagnant
x électrons
pour acquérir une structure électronique externe en DUET ou en
OCTET, un atome A donne un anion
Ax–
|
|