|
L'atome |
|
|
|
|
QCM N° 04 a :
L’atome :
Pour chaque question, indiquer la (ou les) bonne(s)
réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Le noyau d’un atome de fer comportant 26 protons et 30 neutrons est caractérisé
par : |
A = 26 et
Z =
30 |
A = 56 et
Z =
30 |
A = 56 et
Z =
26 |
C |
|
2 |
Le noyau d’un atome d’uranium est caractérisé par A = 235 et Z = 92. Ce noyau contient : |
92 neutrons. |
235 nucléons. |
92 protons |
BC |
|
3 |
Un atome : |
Est électriquement neutre. |
Possède autant de protons que de neutrons. |
Possède autant d’électrons que de protons. |
AC |
|
4 |
La masse d’un atome est à peu
près égale à la masse :
|
De ses protons. |
De ses nucléons. |
De son noyau. |
BC |
|
5 |
Un atome est : |
Cent mille fois plus grand que son noyau. |
105 fois plus grand que son noyau. |
105 fois plus petit que son noyau. |
AB |
|
6 |
Un atome de cobalt Co qui a
perdu 3 électrons devient : |
Un ion
Co3+. |
Un ion
Co3–. |
Un cation. |
AC |
|
7 |
Un ion sulfure S2– est obtenu à partir d’un atome qui : |
A perdu deux électrons. |
A gagné deux électrons. |
A perdu deux protons. |
B |
|
8 |
Le noyau d’un atome de chlore qui possède 35 nucléons et 17 protons a pour notation symbolique |
|
|
|
B |
|
9 |
Les atomes
|
Sont isotopes. |
Appartiennent au même élément chimique. |
Ont le même nombre de neutrons. |
C |
|
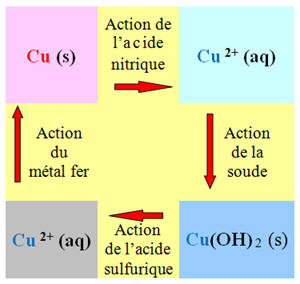
10 |
Au cours de la suite de réactions : |
L’élément cuivre se conserve. |
Cu (s) et Cu2+ possèdent le même nombre d’électrons |
Le noyau de cuivre reste inchangé. |
AC |
►
Structure de l’atome.
-
Un atome est une entité
constituée d’un noyau et d’électrons en mouvement dans le vide
autour du noyau.
-
Le noyau :
-
Le noyau est constitué de
particules appelées nucléons.
-
Les nucléons sont de deux types :
les protons et les neutrons.
►
Grandeurs caractéristiques d’un
atome ou du noyau d’un atome.
-
Le nombre de nucléons est noté
A, on l’appelle aussi le nombre de masse.
-
Le nombre de protons que contient
le noyau est noté Z.
-
On l’appelle aussi le numéro
atomique ou le nombre de charge.
-
Les deux nombres
A et
Z
suffisent pour caractériser un noyau.
-
Le nombre de neutrons que
contient le noyau : A –
Z
-
L’atome étant électriquement
neutre, le nombre d’électrons d’un atome est égal au nombre de
protons.
►
Symbole des atomes.
-
Les atomes sont représentés par
des symboles :
-
En général, la première lettre du
nom écrite en majuscule.
-
On rajoute parfois une deuxième
lettre écrite en minuscule pour éviter les confusions.
-
Formule générale du noyau d’un
atome : ![]()
►
Masse de l’atome.
-
La masse d’un atome est
essentiellement concentrée sur son noyau car la masse des
électrons est négligeable devant celle des nucléons :
-
La masse d’un atome de nombre de
masse A :
m p
≈ m n = m nucléon
-
mAtome ≈
A .
m nucléon
►
Dimension des atomes.
-
Le diamètre d’un atome est de
l’ordre de 10
–10 m.
-
L’atome appartient au domaine de
l’infiniment petit.
-
Le rayon des atomes est de
l’ordre de 100 pm.
-
Le rayon de l’atome est 100 000
fois plus gros que celui du noyau.
-
Entre les électrons et le noyau,
il n’y a que le vide.
►
Les isotopes.
-
Des atomes sont isotopes si leurs
noyaux possèdent le même nombre de protons mais des nombres
différents de neutrons.
►
Les ions.
-
Un ion provient d’un atome ou
d’un groupement d’atomes ayant gagné ou perdu un ou plusieurs
électrons.
-
Un anion (ion chargé moins)
résulte de la capture d’un ou plusieurs électrons.
-
Un cation (ion chargé plus)
résulte de la perte d’un ou plusieurs électrons.
-
Lors du passage d’un atome à un
ion monoatomique, seul le nombre d’électrons change, le noyau
lui n’est pas affecté.
►
L’élément chimique.
-
Un élément chimique est ce qui
est commun à un corps simple et à tous ses composés. Il est
défini par son nombre de charge Z.
-
Le numéro atomique
Z
caractérise un élément chimique.
-
Tous les représentants (atomes ou
ions) d’un élément ont un noyau comportant
Z protons.
-
Tous les atomes d’un même élément
ont le même cortège électronique et des propriétés chimiques
identiques.
-
Au cours des réactions chimiques,
les noyaux n’étant pas modifiés, les différents éléments se
conservent.
|
|