|
QCM N° 09 |
Cohésion de la matière à l’état solide |
|
|
|
|
QCM N° 09
Cohésion de la
matière à l'état solide. Pour chaque question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
La force qui s’exerce entre deux charges électriques distantes de d est : |
Proportionnelle à d |
Inversement proportionnelle à d2 |
Inversement proportionnelle à d |
B |
|
2 |
Le schéma ci-dessous peut correspondre au cas où : |
qA et qB sont deux charges positives |
qA et qB sont deux charges négatives |
qA et qB sont deux charges de signes opposées |
AB |
|
3 |
Un cristal ionique constitué d’ions Al3+ et d’ions O2– a pour formule : |
Al3O2 |
AlO |
Al2O3 |
C |
|
4 |
Dans un cristal ionique de fluorine CaF2, chaque ion Ca2+ : |
N’est entouré que d’ions Ca2+ |
N’est entouré que d’ions F2– |
N’est entouré que d’ions F– |
C |
|
5 |
Une liaison covalente A – B : |
Est polarisée si B est plus électronégatif que A |
Est polarisée si A est plus électronégatif que B |
Est nécessairement polarisée |
AB |
|
6 |
Une molécule triatomique : |
Est nécessairement polaire |
Peut être apolaire |
Peut être polaire |
BC |
|
7 |
Le sulfure de carbone CS2 dont le modèle est donné ci-dessous :
|
Est polaire |
Est apolaire |
A un moment dipolaire non nul |
B |
|
8 |
Les interactions de Van der Waals sont des interactions : |
Entre ions |
Entre dipôles électriques |
Entre molécules |
BC |
|
9 |
Le schéma d’une liaison hydrogène (représentée par - - -) peut être : |
C – H
-
- -
| N |
O – H - - - | N |
F – H - - -H |
B |
|
10 |
Dans le cyclohexane, solide de formule C6H12, la cohésion est assurée : |
par des interactions de Van der Waals |
par des liaisons hydrogène |
Par des liaisons hydrogène et des interactions de Van der Waals |
A |
|
11 |
Dans le phénol, solide de formule :
C6H5
–
OH La cohésion est assurée : |
Uniquement par des liaisons hydrogène |
Par des liaisons hydrogène et des interactions de Van der Waals |
Uniquement par des interactions de Van der Waals |
B |
|
12 |
Lorsque l’on chauffe un corps pur moléculaire solide : |
Sa température augmente nécessairement |
Sa température peut rester constante |
Il fond nécessairement |
B |
|
13 |
Tout apport d’énergie thermique à un corps pur moléculaire solide : |
Augmente l’agitation des molécules |
Rompt des liaisons hydrogène |
Rompt des interactions intermoléculaires |
C |
|
14 |
La transformation de l’état liquide à l’état gazeux d’un corps pur est : |
Une sublimation |
Une ébullition |
Une vaporisation |
C |
|
15 |
En phase condensée, entre les différentes entités chimiques : |
Il n’existe que des forces attractives |
Il n’existe que des forces répulsives |
Il existe des forces attractives et répulsives |
C |
|
16 |
La température d’ébullition de l’éthane (CH3 – CH3) est de – 89 ° C, celle du méthanol (CH3 – OH) est de 65 ° C. Comparées aux interactions entre les molécules de méthanol à l’état liquide, les interactions entre molécules d’éthane à l’état liquide sont : |
Plus importantes |
Moins importantes |
Identiques |
B |
|
17 |
Un cristal ionique d’oxyde de magnésium MgO est composé d’ions : |
Mg2+ et O – |
Mg+ et O 2– |
Mg2+ et O 2– |
C |
|
18 |
Il existe une force attractive entre : |
Deux anions |
Deux cations |
Un anion et un cation |
C |
►
Charges électriques et forces
électriques :
- Charles Augustin Coulomb : 1785.
|
Énoncé ; Deux corps ponctuels A et B, de charges q A et q B, séparés par une distance d, exercent l’un sur l’autre des forces attractives ou répulsives telles que : -
- Caractéristiques des deux forces : -
La force
- La force
- Elles ont la même direction : la droite (AB). - Elles ont des sens opposés. - Elles sont attractives si les charges sont de signes opposés. - Elles sont répulsives si les charges sont de même signe. - Elles ont la même valeur : -
Expression :
|
- La constante k = 9,0 × 10 9 N . m 2 . C– 2.
- Au niveau de la première, on écrit :
-
k = 9,0
× 10
9
S.I
-
En conséquence, la force qui s’exerce entre deux charges
électriques distantes de d est inversement
proportionnelle à d2.
►
Caractéristiques des deux forces :
-
Les forces sont répulsives si les charges sont de même
signe.
-
On considère que : qA . qB >
0

►
Cristal ionique :
- Dans l’écriture de la formule d’un solide ionique, les charges ne figurent pas.
- Par convention, on choisit les plus petits indices qui assurent l’Électroneutralité du cristal.
- La formule statistique indique la nature et la proportion des ions présents dans le cristal sans mentionner les charges.
-
Un cristal ionique constitué d’ions
Al3+
et d’ions O2– a pour formule :
Al2O3.
-
Dans un cristal ionique de fluorine
CaF2,
chaque ion Ca2+ n’est entouré que d’ions
F–.
►
Polarité d’une molécule :
cas des molécules diatomiques :
-
Une molécule, constituée de deux atomes
A et
B, est
polarisée si ces deux atomes ont des électronégativités
différentes.
-
Plus la différence d’électronégativité est importante :
-
Plus la liaison est polarisée
-
Et plus le moment dipolaire
p (A –
B)
est grand.
-
Une molécule diatomique constituée de deux atomes
identique est apolaire.
-
Une molécule diatomique constituée de deux atomes
différents est généralement polaire.
►
Polarité d’une molécule : cas des
molécules triatomiques :
- Molécule d’eau : H – O – H
- L’oxygène est plus électronégatif que l’hydrogène. Les deux liaisons covalentes O – H d’une molécule d’eau sont polarisées.
- Il en résulte l’apparition de charges partielles 2 δ – sur l’atome d’oxygène et d’une charge partielle δ + sur chaque atome d’hydrogène.
|
|
|
Dipôle électrique équivalent |
- Comme le barycentre des charges positives ne coïncide pas avec le barycentre des charges négatives, la molécule présente un caractère dipolaire.
- On dit qu’elle est polaire.
- Autre explication, la molécule possède un moment dipolaire.
- Molécule de dioxyde de carbone : O = C = O
- L’oxygène est plus électronégatif que le carbone. Les deux liaisons covalentes O = C d’une molécule de dioxyde de carbone sont polarisées.
- Il en résulte l’apparition de charges partielles δ – sur chaque atome d’oxygène et d’une charge partielle 2 δ+ sur l’atome de carbone.
|
|
|
Le barycentre des charges positives est confondu avec le barycentre des
charges négatives |
- Comme le barycentre des charges positives coïncide avec le barycentre des charges négatives, la molécule ne présente pas un caractère dipolaire.
- On dit qu’elle est apolaire.
-
En conséquence : Une molécule triatomique peut être
polaire ou apolaire.
►
Molécule de sulfure de carbone :
-
La molécule de sulfure de carbone est apolaire pour des
raisons de symétrie.
►
Interactions de Van der Waals :
- Interactions de Van der Waals : sont des interactions entre dipôles électriques permanents ou instantanés.
- La cohésion d’un solide moléculaire est assurée par des interactions intermoléculaires,
- c’est-à-dire des interactions de Van der Waals auxquelles peuvent s’ajouter des liaisons hydrogène.
-
La liaison hydrogène est représentée par :
![]()
![]()
![]()
![]()

►
Liaison hydrogène :
|
- Une liaison hydrogène se forme lorsqu’un atome d’hydrogène H, qui est lié à un atome A très électronégatif, interagit avec un atome B, également très
électronégatif et porteur d’un ou plusieurs doublets non liants. - Les atomes A et B qui interviennent généralement sont : - l’azote
N, l’oxygène
O, le
fluor F et le chlore
Cl.
-
Les trois atomes qui participent à la liaison hydrogène
sont généralement alignés.
|
-
Les molécules qui possèdent le groupe
– O – H
forment des liaisons hydrogènes.
-
C’est le cas des alcools comme l’éthanol, de l’eau dans
la glace.
-
Ces liaisons hydrogènes participent à la cohésion du
cristal.
-
Dans ce cas, la cohésion du cristal est due aux liaisons
hydrogène et aux interactions de Van Der Waals.
- Représentation de la liaison hydrogène :

►
Le cyclohexane :
- Les interactions de Van der Waals sont des interactions entre dipôles électriques.
- À température ordinaire, c’est un liquide transparent sans couleur, à l'odeur piquante.
- Le cyclohexane est utilisé comme solvant apolaire dans l'industrie chimique,
mais aussi comme réactif pour la production industrielle de l'acide adipique et
du caprolactame, intermédiaires utilisés dans la production du nylon.
- En conséquence la molécule de cyclohexane est apolaire.
- Température de fusion du cyclohexane : 6 ° C
- À l’état solide, la cohésion du cristal moléculaire de cyclohexane est assurée par des interactions entre dipôles électriques instantanés appelées : interactions de Van des Waals.
- Dans la molécule, les électrons n’ont pas de position définie et son en mouvement permanent autour des noyaux au sein du nuage électronique.


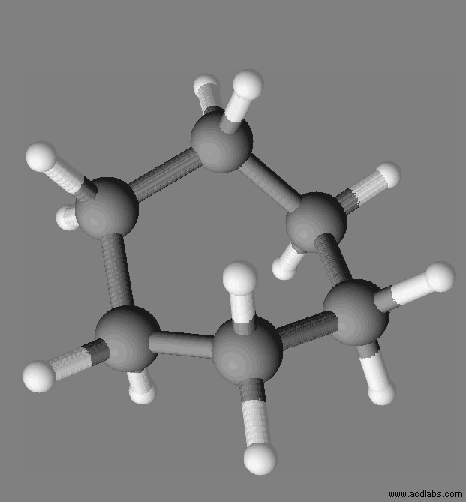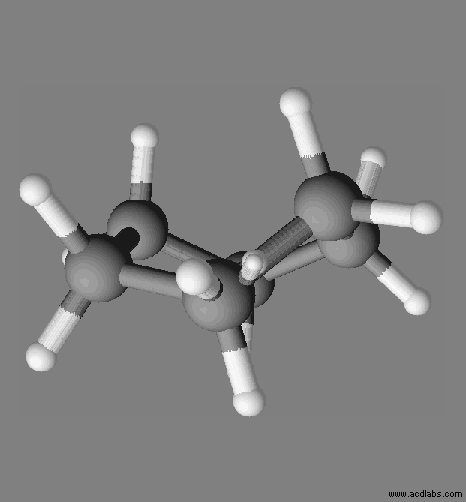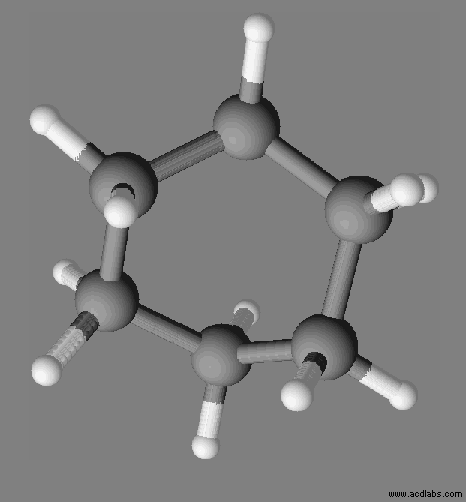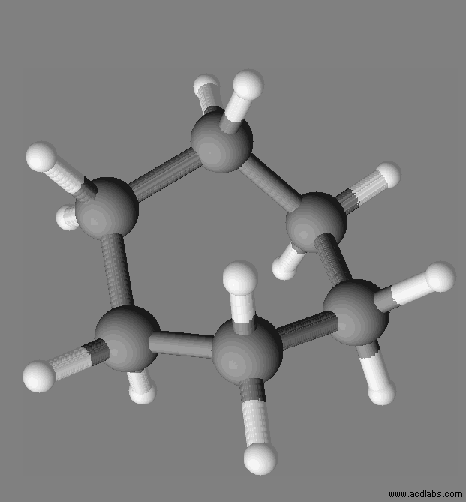
- La molécule comprend des liaisons C – C et des liaisons C – H
- (liaison non polarisée car la différence d’électronégativité en l’atome d’hydrogène et l’atome de carbone est faible χ (H) = 2,2 et χ (C) = 2,55)
- Cas des liaisons carbone – carbone :
- Globalement, les électrons des doublets de liaison se situent statistiquement aussi souvent près d’un noyau que d’un autre.
- C’est la raison pour laquelle la molécule de cyclohexane est apolaire.
- En revanche, à un instant donné, ces électrons peuvent être plus proches de l’un des deux noyaux.
- Un dipôle électrique instantané apparaît alors au sein de la molécule entrainant la formation d’autres dipôles instantanés au sein de la molécule.
- Il en est de même pour toutes les molécules du solide. Les dipôles instantanés ainsi crées interagissent et assurent la cohésion du cristal.
- Ces interactions changent à tout instant, mais leurs effets sont permanents.
Source Wikipédia
►
Le Phénol :
-
Dans le phénol, solide de formule :
C6H5
– OH
-
La cohésion est assurée par des liaisons hydrogène et des
interactions de Van der Waals.

►
On chauffe un solide.
-
Lorsque l’on chauffe un solide, l’énergie thermique
apportée à un corps pur moléculaire peut :
-
Conduire à une élévation de la température avec rupture
d’interactions intermoléculaires et accroissement de l’agitation
des molécules
-
Provoquer un changement d’état avec seulement rupture
d’interaction intermoléculaires, la température restant
constante.
-
Lorsque l’on chauffe un corps pur moléculaire solide sa
température peut rester constante.
►
De l’état liquide à l’état gazeux :
-
La transformation de l’état liquide à l’état gazeux d’un
corps pur est une vaporisation.

►
Phase condensée :
-
En phase condensée, entre les différentes entités
chimiques il existe des forces attractives et répulsives.
►
Méthanol et éthane :
- Éthane : La cohésion est assurée uniquement par des interactions de Van der Waals.
- Méthanol : La cohésion est assurée par des liaisons hydrogène et des interactions de Van der Waals
►
Cristal ionique :
-
Un cristal ionique est électriquement neutre.
-
Un cristal ionique d’oxyde de magnésium
MgO est
composé d’ions : Mg2+ et
O2–
►
Interaction entre les charges
électriques :
-
Deux charges de mêmes signes se repoussent.
-
Deux charges de signes contraires s’attirent.
-
Il existe une force attractive entre : Un anion (–) et un
cation (+).
|
|








