|
QCM N° 05 |
Changement de couleur et réaction chimique. Avancement d'une réaction |
|
|
|
|
QCM °05 Changement de couleur et réaction chimique. Avancement d'une réaction |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
L’avancement x d’une réaction chimique : |
Est une grandeur exprimée en mol |
Diminue au cours d’une réaction |
Augmente au cours d’une réaction |
AC |
|
2 |
Dans un tableau d’avancement, on indique, pour un état donné du système : |
Les masses des espèces chimiques |
Les quantités des espèces chimiques |
Les volumes des espèces chimiques |
B |
|
3 |
Dans un état intermédiaire du tableau d’avancement associé à la réaction : 2 Al + 3 S → Al2S3 |
La quantité restante d’aluminium est n0 (Al) + 2 x |
La quantité restante de soufre est : n0 (S) – 3 x |
La quantité de sulfure d’aluminium formée est : x |
BC |
|
4 |
Si dans un état final les quantités de deux réactifs, exprimées en mol, sont : Réactif 1 : 4,0 – 2 xmax Réactif 2 : 6,0 – 4 xmax |
xmax = 1,5 mol |
Le réactif 1 est limitant |
Le réactif 2 est limitant |
AC |
|
5 |
Dans un mélange stœchiométrique, les quantités des réactifs : |
Sont nulles dans l’état final |
Sont égales dans l’état initial |
Conduisent à la même valeur de l’avancement maximal |
AC |
|
6 |
Après réaction d’un mélange stœchiométrique de réactifs : |
Les réactifs sont entièrement consommés |
L’état final ne contient que des produits |
Il s’est formé la même quantité de chacun des produits |
AB |
|
7 |
La réaction d’équation : 2 H2 + O2 → 2 H2O Assure la propulsion des fusées. Un mélange de dihydrogène et de dioxygène est stœchiométrique si : |
|
|
|
C |
|
8 |
Une solution colorée absorbe :
|
Toutes les radiations du spectre de la lumière blanche |
Principalement certaines radiations |
Une seule radiation |
B |
|
9 |
Un spectrophotomètre affiche : |
L’absorbance d’une solution |
La concentration d’une solution |
La couleur d’une solution
colorée |
A |
|
10 |
L’absorbance d’une espèce colorée en solution est proportionnelle à : |
La concentration molaire de l’espèce colorée |
La longueur d’onde choisie pour la mesurer |
L’épaisseur de la solution colorée traversée |
AC |
|
11 |
À partir du graphe ci-dessous, la loi de Beer-Lambert s’écrit :
|
A = 2 C |
A = 0,20 C |
A = 20 C |
C |
|
12 |
L’absorbance, à la longueur d’onde λ, d’une solution colorée de concentration C introduite dans une cuve de largeur ℓ est : |
Proportionnelle à C et à ℓ |
Proportionnelle à C et inversement proportionnelle à ℓ |
Proportionnelle à C et à λ |
A |
|
13 |
Sur le spectre d’absorption d’une solution colorée d’une espèce de concentration C, présentant une absorbance maximale Amax pour une longueur d’onde λm |
Amax dépend de C mais pas de λm |
λm dépend de C mais pas Amax |
Amax et λm dépendent de C |
B |
|
14 |
À la longueur d’onde λ = 750 nm, l’absorbance d’une solution d’une espèce colorée, de concentration molaire C = 5,0 × 10 – 4 mol / L, introduite dans une cuve de longueur ℓ = 1,0 cm vaut A = 0,75. À cette longueur d’onde, le coefficientd’absorption molaire ε (λ) de l’espèce vaut : |
2,0 mol–1. L . cm–1 |
1,5 × 106 mol–1. L . m–1 |
1,5 × 103 mol–1. L . cm–1 |
C |
|
15 |
Pour tracer une droite d’étalonnage pour un dosage spectrophotométrique, il faut mesurer l’absorbance de solutions : |
D’espèces chimiques différentes |
D’une même espèce chimique à des longueurs d’ondes différentes |
D’une même espèce chimique pour des solutions de concentrations différentes |
C |
►
Tableau
d’avancement : exemple
-
L’avancement
x d’une
réaction chimique augmente au cours d’une réaction chimique 0
≤ x
≤ xmax.

-
L’unité d’avancement d’une
réaction chimique est la mole (mol).
►
Tableau
d’avancement :
-
Dans un tableau d’avancement, on
fait intervenir les quantités de matières.
-
Exemple :
►
Tableau
d’avancement (3) :
-
Lorsque l’avancement est
x :
-
La quantité restante d’aluminium
est : n0
(Al)
– 2 x
-
La quantité restante de soufre
est : n0 (S) – 3
x
-
La quantité de sulfure
d’aluminium formée est : x
►
État final :
réactif limitant, réactif en excès.
-
Pour le réactif 1 : 4,0 – 2
xmax1
=
xmax1 =
2,0 mol
-
Pour le réactif 2 : 6,0 – 4
xmax2
=
xmax2 =
1,5 mol
- L’avancement maximal est égal à la plus petite des deux valeurs :
- Car on ne peut pas consommer plus de réactif
qu’il n’y en a au départ
-
En conséquence,
xmax
= xmax2
= 1,5 mol
< xmax1
-
Le réactif
2 est limitant
et le réactif 1 est en excès.
►
Mélange
stœchiométrique :
-
Dans certains cas, à la fin de la
réaction, tous les réactifs ont été entièrement consommés.
-
On dit que dans l’état initial,
les réactifs ont été introduits dans les proportions
stœchiométriques :
-
Le mélange est stœchiométrique.
-
Dans l’état initial, les réactifs
ont été introduits dans les proportions définies par les
coefficients de la réaction.
-
Les quantités de matières des
réactifs sont nulles dans l’état final.
-
Les quantités de matières des
réactifs, introduites dans l’état initial, conduisent à la même
valeur de l’avancement maximal.
-
L’état final ne contient que des
produits.
►
Mélange
stœchiométrique de dihydrogène et de dioxygène :
►
Solution aqueuse
de permanganate de potassium :
-
Une solution colorée absorbe
principalement certaines radiations.
-
La solution de permanganate de
potassium absorbe principalement dans le vert (bande noire).

-
Une solution de permanganate de
potassium a une couleur magenta (plus ou moins foncée suivant la
concentration)
►
Le
spectrophotomètre :
- On utilise le fait que toute solution colorée absorbe la lumière visible (400 nm < λ0 < 800 nm).
- Lorsqu’un faisceau de lumière monochromatique traverse un milieu absorbant, l’intensité lumineuse I du faisceau transmis est inférieure à l’intensité lumineuse I 0 du faisceau incident.
- Pour évaluer cette diminution, on utilise :
-
La transmittance
T :

-
L’absorbance
A :

- La transmittance s’exprime en pourcentage.
- À une transmittance T de 100 % (T = 1) correspond une absorbance nulle : A = 0.
- à une transmittance de 1 % (T = 0,01) correspond une absorbance A =log 100 = 2.
- Exemple de réaction : on peut utiliser cette méthode lorsqu’une espèce colorée se forme ou disparaît au cours de la réaction.
- Exemple : Réaction entre l’eau oxygénée et les ions iodure : il se forme du diiode qui est une espèce chimique colorée.
►
Principe de
fonctionnement.
- Un système dispersif (prisme ou réseau) permet de sélectionner une radiation lumineuse de longueur d’onde donnée.
- Cette radiation est dirigée vers l’échantillon à analyser. Le flux lumineux transmis est mesuré et converti en valeur d’absorbance.
►
Loi de
Beer-Lambert :
-
L’absorbance d’une solution diluée contenant une espèce
colorée est proportionnelle à la concentration (effective)
C
de cette espèce et à l’épaisseur
ℓ (cm) de la solution
traversée par le faisceau lumineux.
-
A (λ) =
ε (λ) .
ℓ .
C
-
ε (λ) est appelé coefficient d’extinction
molaire ou coefficient d’absorption molaire.
- Il dépend de la nature de l’espèce dissoute et de la longueur d’onde de la radiation utilisée.
-
Il dépend également du solvant et de la température. (mol – 1.L.cm
– 1).
►
Spectre
d’absorption d’une espèce colorée :
-
L’absorbance d’une solution colorée dépend de la longueur
d’onde de la radiation lumineuse utilisée.
-
On donne l’absorbance d’une solution de diiode en
fonction de la longueur d’onde :
- Pour une solution de diiode de concentration C = 1,0 mmol / L, on mesure l’absorbance A pour différentes longueurs d’ondes.
- La plage de variation de la
longueur d’onde se situe dans l’intervalle suivant :
-
400 nm <
λ < 700 nm.
- On règle la longueur d’onde sur la valeur souhaitée, on fait le blanc avec la solution étalon, puis on mesure l’absorbance.
- Il faut répéter le mode opératoire pour chaque
mesure.
►
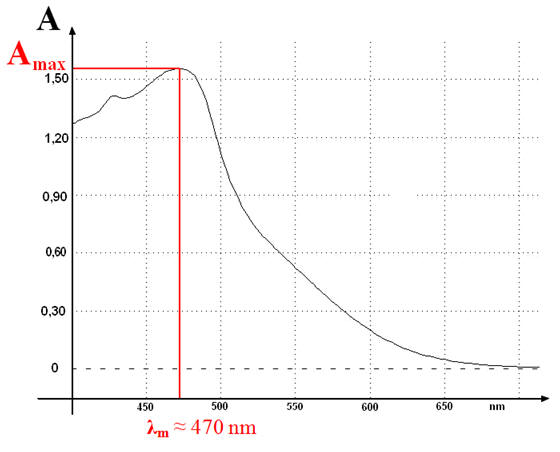
Courbe obtenue :
-
Absorbance maximale
Amax
:
-
L’absorbance maximale
Amax
est obtenue pour λm ≈ 470 nm.
-
L’absorbance
Amax
d’une solution colorée
dépend de la concentration de la solution colorée.
-
Alors que λm dépend de
la nature de la solution.
►
Exploitation du
graphe :

-
On est en présence d’une portion
de droite qui passe par l’origine.
-
Dans le domaine de concentration
étudiée, l’absorbance de la solution est proportionnelle à la
concentration de la solution :
-
A =
a
. C
-
Détermination de la valeur du
coefficient a :
-
Le coefficient de
proportionnalité a est égal au coefficient directeur de
la droite tracée.
-

-
Relation :
A =
f (C).
-
A =
20
× C
►
Absorbance d’une
solution :
-
Loi de Beer-Lambert :
|
-
L’absorbance d’une solution
diluée contenant une espèce colorée
-
A (λ) =
ε (λ)
. ℓ .
C -
ε (λ)
est appelé coefficient
d’extinction molaire ou coefficient d’absorption molaire.
-
Il dépend de la nature de
l’espèce dissoute et de la longueur d’onde de la radiation
utilisée. -
Il dépend également du solvant et
de la température. (mol – 1.L.cm
– 1)). |
► Coefficient
d’absorption molaire ε (λ) :
-
Loi de Beer-Lambert :
-
A (λ) =
ε (λ)
. ℓ .
C
-
ε (λ)
est appelé coefficient
d’extinction molaire ou coefficient d’absorption molaire.
-

|
|