|
Phys. N° 03 |
Sources de lumières colorées Cours. |
|
|
Mots clés : sources de lumières colorées, les différentes sources lumineuses, source chaude, source froide, dispersion de la lumière blanche par un prisme, profil spectral, loi de Wien, lumière émise par une source chaude, lumière émise par une source froide, le photon, quantification de l'énergie d'un atome, émission de lumière, absorption de lumière, spectre solaire, température de la surface du Soleil, composition chimique du Soleil, Astrophysique, QCM, ... |
|
|
|
II-
Lumière émise par une source chaude. |
|
III-
Lumière émise par une source froide. |
|
IV-
Interprétation du spectre de la
lumière du Soleil. 2)-
Température de la surface du Soleil. |
|
Certaines images ont été réalisées
le logiciel
CHROMA
|
|
|
|
Exercices : énoncé avec correction a)- Exercice 8 page 55. Exploiter la relation entre fréquence et longueur d’onde b)- Exercice 10 page 55. Comprendre et exploiter la loi de Wien. c)- Exercice 13 page 55. Calculer des énergies et des longueurs d’onde. d)- Exercice 14 page 55. Exploiter un diagramme d’énergie. e)- Exercice 17 page 56. Lampe à vapeur de sodium. f)- Exercice 19 page 56. Spectre d’Arcturus. g)- Exercice 23 page 58. Vérifier la loi de Wien. |
I-
Les différentes sources lumineuses.
On distingue :
► Les sources chaudes dont l’émission de lumière est d’origine thermique :
-
Le Soleil, les lampes à incandescence, les lampes
halogènes, la flamme d’une bougie, …
► Les sources froides dont l’émission de lumière à lieu sans échauffement :
-
Le tubes fluorescents, lampes fluo-compactes, les lasers,
les diodes électroluminescentes, …
2)-
Dispersion de la lumière blanche par un prisme.
a)- Expérience de Newton (1642 – 1727).
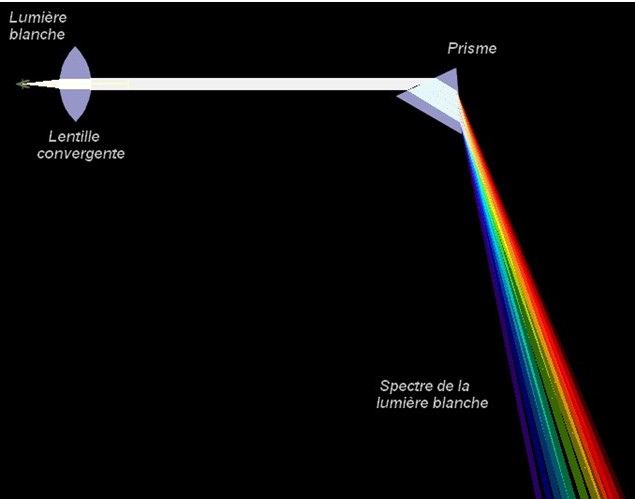
![]() Expérience : on éclaire une fente avec une lumière
blanche et on envoie le faisceau obtenu sur la face d’un prisme.
Expérience : on éclaire une fente avec une lumière
blanche et on envoie le faisceau obtenu sur la face d’un prisme.
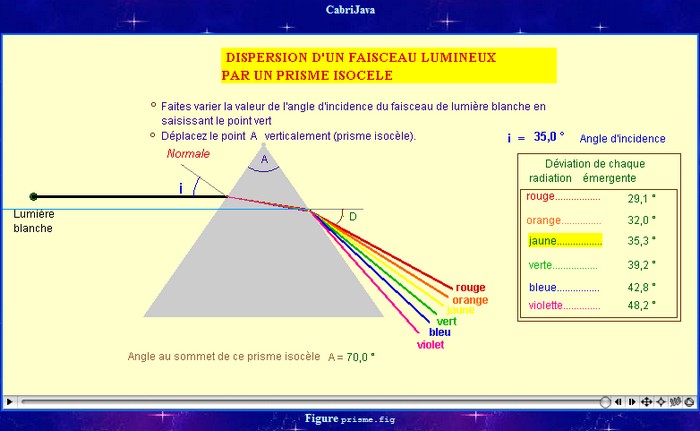
Animation CabriJava :
déviation par un prisme
Spectre de la lumière blanche :
-
Observations :
-
La lumière est déviée par le prisme.
-
De plus le faisceau qui émerge du prisme est étalé et
présente les différentes couleurs de l’arc-en-ciel (rouge,
orange, jaune, vert, bleu, indigo, violet).
-
La lumière rouge est moins déviée que la lumière
violette.
![]() Conclusion 1 :
Conclusion 1 :
-
Le prisme dévie et décompose la lumière blanche en
lumières colorées du rouge au violet.
-
C'est un phénomène de dispersion.
-
L'ensemble des couleurs obtenues constitue le spectre de
la lumière blanche.
-
Le spectre est continu du rouge au violet.
-
La lumière blanche est constituée de plusieurs couleurs
ou radiations : c’est une lumière polychromatique.
► Exemple : Arc en Ciel :
b)- Expérience avec la lumière émise par un Laser.
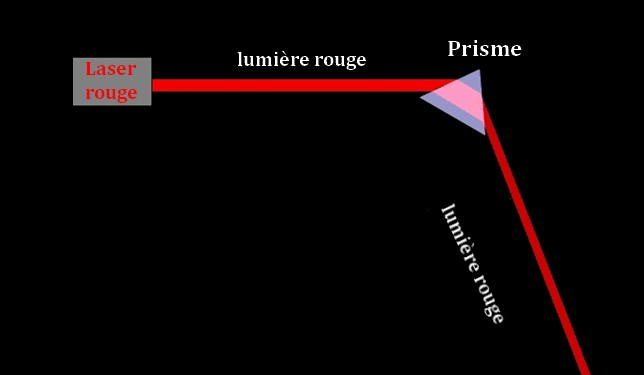
![]() Expérience : on éclaire une fente avec un faisceau
laser et on envoie le faisceau obtenu sur la face d’un prisme.
Expérience : on éclaire une fente avec un faisceau
laser et on envoie le faisceau obtenu sur la face d’un prisme.
-
Observation :
-
Le faisceau laser est dévié et le spectre ne comporte
qu’une seule couleur, la couleur rouge initiale.

Spectre du faisceau laser

![]() Conclusion 2 :
Conclusion 2 :
-
La lumière produite par un laser est constituée d’une
seule radiation, elle est monochromatique.
![]() Conclusion 3 :
Conclusion 3 :
-
Il existe les sources monochromatiques qui émettent une
seule radiation lumineuse et les sources polychromatiques qui
émettent plusieurs radiations lumineuses.
c)- Radiation et longueur d’onde.
-
Une lumière monochromatique ne peut être décomposée par
un prisme.
-
C’est une radiation lumineuse qui est caractérisée par sa
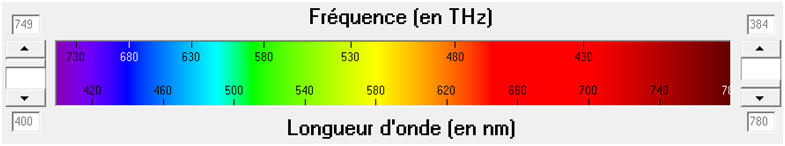
longueur d’onde λ0 dans le vide ou l’air.
-
Son unité légale est le mètre (m). On utilise souvent le
nanomètre (nm) pour les radiations lumineuses
-
Le laser rouge utilisé au lycée est une radiation de
longueur d’onde λ
=
633 nm.
-
C’est une lumière monochromatique.
-
Remarque : une lumière complexe est un mélange de
plusieurs radiations.
-
Elle n’est pas caractérisée par une longueur d’onde.
-
On lui associe une plage de longueurs d’onde.
![]() Une radiation lumineuse est caractérisée par :
Une radiation lumineuse est caractérisée par :
-
Sa fréquence ν (en Hz) ou sa période
T (en
s)
- Et
-
Sa longueur d’onde dans le vide
λ0.
-
Remarque :
-
La fréquence ν d’une radiation lumineuse ne dépend
pas du milieu de propagation alors que la longueur d’onde
λ
dépend du milieu de propagation.
- Les radiations lumineuses sont des ondes électromagnétiques.
![]() Relation fondamentale :
Relation fondamentale :
-
La longueur d’onde dans le vide d’une radiation lumineuse
est donnée par la relation :

-
Remarque : Pour les radiations lumineuses, on préfère
utiliser la lettre grecque ‘’nu’’.
-
De manière générale, on caractérise une radiation
lumineuse par sa longueur d’onde dans le vide
λ0.
-
Le plus souvent, lorsque l’on donne la longueur d’onde
d’une radiation, il est sous-entendu que c’est celle dans le
vide ou dans l’air.
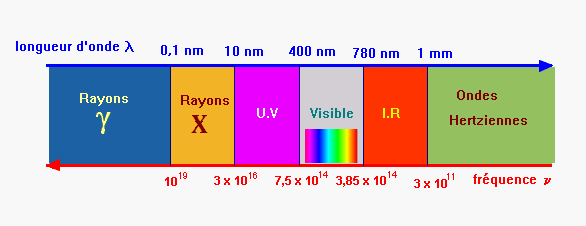
- L’œil humain n’est sensible qu’aux radiations dont les
longueurs d’onde sont comprises entre 400 nm et 800 nm.
- La lumière blanche est un mélange de toutes les
radiations visibles.
II-
Lumière émise par une source chaude.
-
Le profil spectral, d’un corps, représente l’intensité
lumineuse des radiations émises par ce corps en fonction des
longueurs d’onde de ces radiations.
-
Le profil spectral d’un corps chaud dépend de sa
température.
-
La couleur d’un corps chaud dépend de sa température.
-
Exemples : on donne le profil spectral d’un corps chaud à
deux températures différentes.

-
Les températures sont données en kelvin (K) qui est la
température absolue :
- Relation entre degré Celsius et kelvin :
- T (K) = θ (° C) + 273,15
-
On remarque que le
spectre
d’un corps incandescent dépend de la température de ce corps.
-
Plus le corps est
chaud
et plus le spectre s’étend vers le
violet.
-
En conséquence, une source de couleur bleue est plus
chaude qu’une source de couleur rouge.
2)- Loi de Wien. Voir : Exercice 14 : Lien :
Loi de Wien
Cours de
seconde,
vers exercice.
-
Un corps chaud émet de la lumière dont le spectre et le
profil spectral dépendent de la température.
-
En physique, un « corps noir » est un objet idéal
émettant un rayonnement qui n’est fonction que de sa
température.
-
La loi de Wien relie la température
θ de ce corps
noir et la longueur d’onde λ
max
pour
laquelle le profil spectral de la lumière qu’il émet passe par
un maximum.
-
La température θ s’exprime en degré Celsius et la
longueur d’onde λ
max
en nm.
-
Ces deux grandeurs sont liées par la loi de Wien :
-

-
Cette loi permet d’évaluer la température d’une étoile à
partir de son profil spectral.
-
Exemple :
-
On donne le profil spectral d’une étoile.
-
En déduire la température de la surface de cette étoile à
partir de son profil spectral
-

-
La température de surface du corps chaud est d’environ
6000 °C.
-
La loi de Wien permet d’évaluer la température de surface
θ en °C d’un corps chaud à partir de la connaissance de
la longueur d’onde λ
max en nm de la radiation
émise avec le maximum d’intensité.
III- Lumière émise par une source froide.
-
En 1900, Max Planck fut conduit à postuler la
quantification de l’énergie transportée par les ondes
électromagnétiques.
-
Il postule que l’énergie électromagnétique ne peut
s’échanger que par « paquets » ou quanta d’énergie.
-
En 1905, Albert Einstein émet l’idée que ces quanta
d’énergie sont transportés par des photons.
-
Les photons sont des particules de masse nulle et de
charge nulle se propageant à la vitesse de la lumière.
-
Énergie d’un photon :
-
E =
h .
ν ou
![]()
-
Pour une onde électromagnétique de fréquence
ν et
de longueur d’onde λ dans le vide
-
La grandeur h est la constante de Planck :
h
= 6,62
× 10 – 34
J.s.
-
La grandeur c représente la valeur de la vitesse
de la lumière dans le vide :
-
c = 3,00 x 10 8
m / s
-
Autre écriture :
![]() .
.
-
L’énergie E s’exprime en joule.
-
Comme les valeurs des énergies des atomes, exprimées en
joule (J) sont extrêmement faibles, on préfère utiliser le plus
souvent comme unité d’énergie, l’électron-volt (eV)
-
Correspondance : 1 eV = 1,6
× 10 – 19
J
2)- Quantification de l’énergie des
atomes.
-
En 1913, BOHR énonce les postulats suivants :
-
Les variations d’énergie d’un atome sont quantifiées.
-
L’atome ne peut exister que dans certains états d’énergie
ou niveaux d’énergie bien définis.
-
Un photon de fréquence
ν est émis lorsque l’atome
effectue une transition d’un niveau d’énergie
Ep
vers un niveau inférieur En tel que :
-
Ep -
En =
h .
ν
-
Il résulte de ceci que les énergies d’un atome sont
quantifiées.
-
Le diagramme des niveaux d’énergie d’un atome représente
les niveaux d’énergie possibles de cet atome.
-
Exemple :
-
Diagramme simplifié des niveaux d’énergie de l’atome
d’hydrogène (tous les états excités ne sont pas représentés).

-
L’état de plus basse énergie correspond à l’état
fondamental.
-
Dans l’état fondamental,
n = 1 :
E 1
= - 13,6 eV
-
Les autres états sont qualifiés d’états excités. Il en
existe une infinité.
-
Lorsque E = 0, l’atome est ionisé.
-
Dans ce cas, l’atome d’hydrogène a perdu son électron. On
est en présence d’un proton.
-
La perte d’énergie d’un atome excité passant du niveau
d’énergie Ep vers un niveau inférieur En
s’accompagne de l’émission d’un photon d’énergie :

-
ΔE = Ep -
En =
h
. ν
► Application :
-
On donne une partie du diagramme des niveaux d’énergie de
l’atome d’hydrogène.

-
Calculer la longueur d’onde
λ31
du
photon émis au cours de la transition du niveau 3 au niveau 1.
-
Calculer la longueur d’onde
λ32 du
photon émis au cours de la transition du niveau 3 au niveau 2.
► Réponses :
-
Longueur d’onde λ
31 du photon émis au
cours de la transition du niveau 3 au niveau 1.
-

-
Application numérique :
-

-
Cette radiation n’est pas visible. Elle appartient au
domaine des UV.
-
Longueur d’onde λ32 du photon émis au
cours de la transition du niveau 3 au niveau 2.
-

-
Application numérique :
-

-
Cette radiation appartient au domaine du visible. Elle
est de couleur rouge.

-
L’absorption d’énergie lumineuse par un atome ne peut se
faire que si l’énergie du photon permet une transition d’un
niveau En
à un niveau supérieur
Ep
tel que :

-
ΔE = Ep -
En =
h
.
n
-
Un atome ne peut absorber que les radiations qu’il est
capable d’émettre.
► Application :
-
On donne une partie du diagramme des niveaux d’énergie de
l’atome d’hydrogène.

-
Calculer la longueur d’onde
λ21
du
photon absorbé au cours de la transition du niveau 1 (état
fondamental) au niveau 2.
► Réponse :
-

- Application numérique :
-

-
Cette radiation n’est pas visible. Elle appartient au
domaine des UV.
IV- Interprétation du spectre de la lumière du Soleil.
- Profil spectral et spectre simplifiée de la lumière émise par le Soleil.
- Le profil spectral d’une étoile est la courbe qui représente l’intensité lumineuse des radiations émises par cette étoile en fonction de la longueur d’onde.
- Les entités chimiques présentes dans l’atmosphère du Soleil absorbent certaines radiations lumineuses.
- Ceci se traduit par l’apparition de raies sombres dans le spectre de la lumière émise par le Soleil et par des minima d’intensité lumineuse dans le profil spectral.
- Les longueurs d’onde correspondantes permettent d’identifier les entités chimiques présentes dans l’atmosphère du Soleil.
2)- Température de la surface du Soleil.
- La température de surface du Soleil exerce une influence sur l’allure globale du profil spectral.
- La longueur d’onde du maximum d’intensité lumineuse est notée λmax.
- La valeur de λmax diminue lorsque la température de surface de l’étoile augmente.
- Une étoile bleue est plus chaude qu’une étoile rouge.
- Le profil spectral de la lumière émise par le Soleil permet de déterminer la valeur de λmax.
- λmax = 480 nm.
- Cette valeur permet de déterminer la valeur de la température de la surface du Soleil grâce à la loi de Wien :
-

- Cette température est voisine de 5700 °C.
3)- Composition chimique du Soleil.
Lien vers : Applications à l’Astrophysique.
a)- Spectres d’émission et spectres d’absorption
- On a vu qu’un atome émet un photon quand il passe d’un niveau d’énergie supérieur Ep à un niveau d’énergie inférieur En.
- Mais, il peut aussi absorber un photon de même énergie lorsqu’il passe du niveau inférieur En au niveau supérieur Ep.
- Cela explique la présence de raies noires dans les spectres d’absorption.
- Pour une même entité chimique, les raies noires du spectre d’absorption ont les mêmes longueurs d’onde dans le vide que les raies colorées du spectre d’émission.
► Cas de l’Hydrogène :
- Spectre d’émission :
- Spectre d’absorption :
- Une entité chimique ne peut absorber que les radiations qu’elle est capable d’émettre.
- Les raies d’émission ou d’absorption permettent d’identifier une entité chimique présente dans un gaz.
b)- Conclusion.
|
- Les raies noires présentes dans le spectre de la lumière provenant du Soleil ou les minima d’intensité lumineuse de son profil spectral permettent d’identifier les espèces chimiques présentes dans l’atmosphère solaire. - L’atmosphère du Soleil contient des éléments chimiques. - La partie haute de l’atmosphère absorbe une partie de la lumière émise dans la partie basse. - Il en résulte des raies d’absorption dans le spectre continu. - Ce sont les raies d’absorption des éléments chimiques présents dans l’atmosphère du Soleil. - Si le Soleil ne comportait pas d’atmosphère, le spectre de la lumière émise serait continu. - L’existence des raies d’absorption est dû à la présence d’une atmosphère autour du Soleil, appelée chromosphère. - Le gaz présent est principalement de l’hydrogène. On trouve aussi des ions He+, Ca2+, Fe2+, … - La partie haute de l’atmosphère absorbe une partie de la lumière émise dans la partie basse. - Les travaux de Fraunhofer et Kirchhoff ont permis de connaître la composition de l’atmosphère du Soleil. - Un spectre d’émission ou d’absorption est caractéristique des atomes ou des ions. - Un spectre de raies d’émission ou d’absorption permet d’identifier une entité chimique (atome ou ion). - C’est sa carte d’identité, sa signature. - « dès 1814, le physicien allemand Fraunhofer remarque la présence de raies noires dans le spectre du Soleil. - Kirchhoff mesure la longueur d’onde de plusieurs milliers de ces raies et montre qu’elles coïncident avec celles émises par diverses entités chimiques : - Hydrogène, calcium, cuivre, fer, zinc, … - Il publie, en 1861, le premier atlas du système Solaire. » |
1)- QCM : Pour chaque question, indiquer la (ou les) bonne(s) réponse(s).
|
|
2)- Exercices : Exercices : énoncé avec correction
a)- Exercice 8 page 55. Exploiter la relation entre fréquence et longueur d’onde
b)- Exercice 10 page 55. Comprendre et exploiter la loi de Wien.
c)- Exercice 13 page 55. Calculer des énergies et des longueurs d’onde.
d)- Exercice 14 page 55. Exploiter un diagramme d’énergie.
e)- Exercice 17 page 56. Lampe à vapeur de sodium.
f)- Exercice 19 page 56. Spectre d’Arcturus.
g)- Exercice 23 page 58. Vérifier la loi de Wien.
|
|