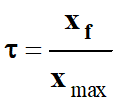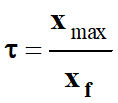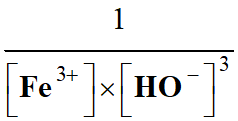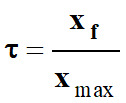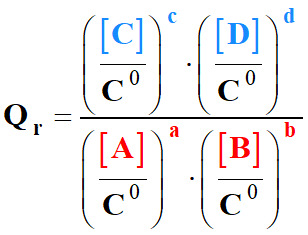|
Évolution spontanée d’un système chimique. |
|
|
|
|
|
|
QCM N° 06
Évolution
spontanée d’un système chimique
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Soit la réaction
d’équation :
Pb2+
(aq) + 2 I– (aq) → PbI2 (s).
Les quantités de
matière
à l’état initial
sont :
n0
(Pb2+) = 0,10 mol
et n0
(I–) = 0,15 mol.
Le (ou les)
réactif(s) (s)
est (sont) :
|
Pb2+
(aq) |
I–
(aq) |
Pb2+
(aq)
Et
I-
(aq) |
B |
|
2 |
L’expression du
taux
d’avancement
final τ est : |
|
|
|
B |
|
3 |
Pour une
transformation
non totale, le
taux
d’avancement
final τ est : |
Strictement
inférieur à 1 |
Égal à 1 |
Strictement
supérieur à 1 |
A |
|
4 |
Le taux
d’avancement final τ
d’une réaction
totale est : |
τ
= 1 |
τ
= 0,50 |
τ
= 0,99 |
AC |
|
5 |
Le quotient de
réaction
de l’équation : Fe3+ (aq) + 3 HO– (aq)
→ Fe (OH)3
(s)
|
[Fe3+]
+ 3 [HO-] |
[Fe3+]×[HO–]3 |
|
C |
|
6 |
La constante
d’équilibre
d’une
transformation
chimique dépend :
|
Du sens
d’écriture
de la
transformation |
De la
température |
Des quantités
initiales de
matière des
réactifs |
AB |
|
7 |
Une
transformation est
modélisée par une
réaction
dont le quotient
de réaction
Qr,i
à l’état initial est supérieur
à sa constante
d’équilibre K (T).
Le système
subissant cette
transformation :
|
Évolue dans
le sens direct |
N’évolue
pas |
Évolue
dans
le sens
indirect |
C |
|
8 |
Connaissant le
nombre N
d’électrons
traversant
la section d’un
fil pendant
la durée Δt,
l’intensité I
du courant
électrique
continu vaut :
|
|
|
|
A |
|
9 |
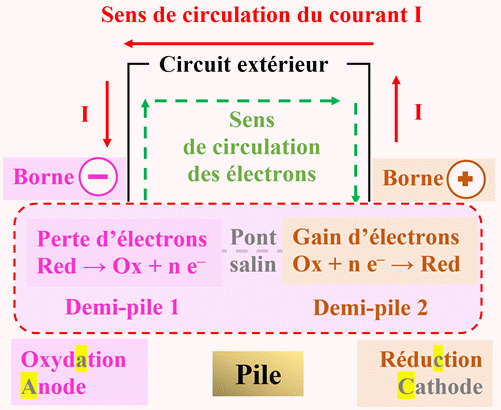
Dans une pile, le
transfert
d’électrons se
fait par : |
Contact entre
les réactifs |
Un circuit
électrique
extérieur |
Contact entre
les produits |
B |
|
10 |
Dans une pile,
l’électrode
où a lieu la
réduction est : |
Le lieu où
les électrons
sont
consommés |
Le lieu
d’où sortent
les électrons
quand la pile
débite |
Le pôle
négatif de
la pile |
A |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Réactif limitant :
-
L’avancement maximal : xmax.
-
L’avancement maximal xmax correspond à la plus petite valeur de l’avancement
pour laquelle la quantité finale de l’un au moins des réactifs est nulle.
-
Ce réactif est alors appelé : réactif limitant.
-
Cas de la réaction considérée :
Pb2+ (aq) + 2 I– (aq) →
PbI2 (s).
-
Tableau d’avancement :
|
Équation
chimique |
Pb2+
(aq) + 2 I– (aq) → PbI2 (s) |
|||
|
Espèces
chimiques |
Pb2+
(aq) |
I–
(aq) |
|
PbI2
(s) |
|
Quantité
de matière |
n0
(Pb2+)
= 0,10 mol
|
n0
(I–)
= 0,15 mol |
|
n
(PbI2)
|
|
Coefficients
stœchiométriques |
1 |
2 |
|
1 |
-
Pour connaître le réactif limitant, il
faut comparer les quantités :
-
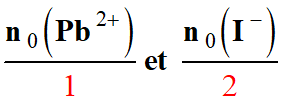
- 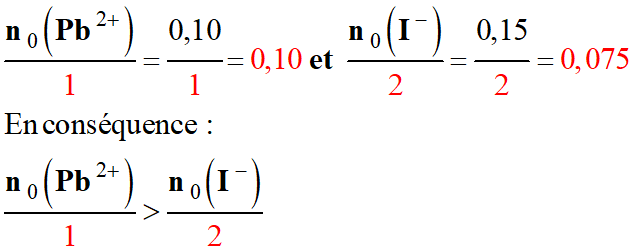
-
L’ion
I- (aq) est le
réactif limitant.
-
En fin de réaction, il reste des ions
Pb2+ (aq).
-
Les ions
Pb2+ (aq) sont en
excès.
Taux d’avancement d’une réaction chimique :
-
Le taux d’avancement final d’une réaction, noté
τ (tau), est le quotient de
l’avancement final par l’avancement maximal :
|
|
|
|
τ
(tau) |
Taux d’avancement
final (sans unité) |
|
xf |
Avancement final (mol) |
|
xmax |
Avancement maximal
(mol) |
Transformation non totale et totale :
-
Le taux d’avancement final τ permet de qualifier une réaction chimique.
-
Si τ = 0, la réaction n’a pas lieu.
-
Pour une réaction totale : τ = 1 car
xf = xmax
-
Pour une réaction non totale : 0 <
τ < 1 car
xf <
xmax
-
On peut exprimer cette grandeur en pourcentage.
Quotient de réaction :
-
Considérons la réaction chimique non totale suivante :
a
. A
(aq) +
b
.
B
(aq)
![]() c
. C
(aq) +
d
.
D
(aq)
c
. C
(aq) +
d
.
D
(aq)
-
Par définition, le quotient de réaction Qr
de cette réaction s’écrit :
|
|
|
|
Qr
|
Quotient de réaction (sans unité) |
|
[C]
et [D] |
Concentration des produits (mol . L–1) |
|
[A]
et
[B] |
Concentration des réactifs (mol . L–1) |
|
C0 |
Concentration standard : C0 =
1,0 mol . L–1 |
-
Pour simplifier l’expression, on omet de mettre la concentration standard C0.
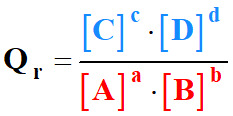
-
Mais, il ne faut pas oublier que le
quotient de réaction est une grandeur
sans unité qui caractérise un système chimique dans un état donné :
-
Par convention, l’eau,
solvant, n’intervient pas dans
l’écriture de l’expression de Qr
(même s’il intervient dans l’équation de la réaction).
-
Les espèces chimiques solides n’apparaissent pas dans l’expression du quotient
de réaction.
-
Cas de la réaction :
Fe3+
(aq) + 3 HO– (aq) → Fe (OH)3 (s)
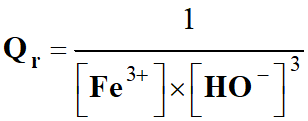
Constante d’équilibre :
-
Dans l’état d’équilibre d’un système, le quotient de réaction
Qr,éq prend une valeur qui
ne dépend pas de l’état initial.
-
La valeur de Qr,éq est indépendante de la composition initiale.
-
Cette valeur ne dépend que de la température.
-
Elle est appelée constante d’équilibre et on la note
K.
K = Qr,éq
-
La valeur de la constante d’équilibre nous renseigne sur la nature de la
réaction chimique.
-
Si K ≥ 104 la
transformation chimique est quasi-totale (on dit aussi totale).
-
Si K ≈ 1 la transformation chimique
est équilibrée.
-
Si K ≤ 10–4 la transformation chimique est très limitée.
-
Si la disparition d’un réactif intervient alors que la valeur du quotient de
réaction Qr, n’a pas
atteint la valeur de K, la réaction
est totale.
Sens d’évolution d’une transformation chimique :
-
Système chimique hors d’équilibre :
-
Tout système chimique, hors d’équilibre, évolue spontanément vers un état
d’équilibre.
-
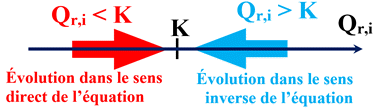
À une température donnée, la comparaison du quotient de réaction dans l’état
initial, Qr,i
à la constante d’équilibre K
permet de prévoir le sens d’évolution spontanée du système chimique.
-
Considérons la réaction suivante avec la terminologie associée :
|
|
|
|
Sens direct
|
|
|
|
|
a A
(aq) |
+ |
b B
(aq) |
|
c C
(aq) |
+ |
d D
(aq) |
|
|
|
|
Sens inverse
|
|
|
|
-
Premier cas :
-
Si le quotient de réaction initial Qr,i
est égal à la constante d’équilibre K,
-
soit Qr,i =
K, le système est déjà à l’équilibre.
-
Il n’évolue pas.
-
Deuxième cas :
-
Si le quotient de réaction initial
Qr,i est inférieur à la
constante d’équilibre K,
-
soit Qr,i
< K,
-
Le système chimique évolue spontanément vers un état d’équilibre.
-
Il évolue dans le
sens direct
de l’écriture de l’équation de la réaction.
-
Troisième cas :
-
Si le quotient de réaction initial Qr,i
est supérieur à la constante d’équilibre
K,
-
soit Qr,i
>
K, le système chimique évolue
spontanément vers un état d’équilibre.
-
Il évolue dans le
sens inverse
de l’écriture de l’équation de la réaction.
-
Capacité électrique d’une pile :
|
Qmax
= n (e–)max . NA
. e |
|
|
Qmax |
Capacité électrique de la pile
(coulomb : C) |
|
n
(e–)max |
Quantité maximale d’électrons
échangés (mol) |
|
NA |
Nombre d’Avogadro (mol–1) NA = 6,02 × 1023
mol–1 |
|
e |
Charge élémentaire (coulomb : C) e = 1,60 × 10–19 C |
-
La capacité électrique d’une pile est la charge électrique maximale
Qmax que la pile peut
débiter durant sa durée de vie.
-
La quantité maximale n (e–)max
d’électrons échangés se détermine à partir de la quantité du
réactif limitant.
-
Il ne faut pas confondre la capacité électrique d’une pile
Qmax avec le quotient de
réaction Qr d’une réaction
chimique.
-
![]()
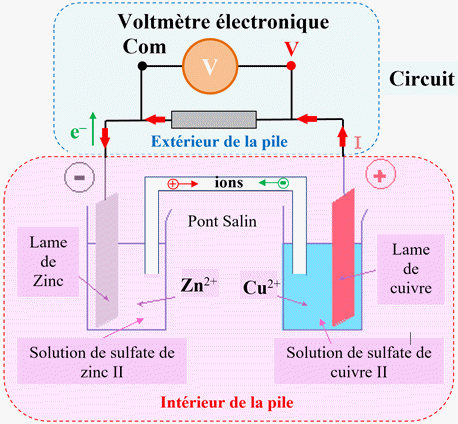
Fonctionnement d’une pile :
-
Cas de la pile zinc-cuivre :
ou
Réaction aux électrodes d’une pile :
-
Le pôle
– de la
pile est le siège d'une
oxydation
(les électrons sont cédés),
-
On l'appelle
l'anode.
-
Le pôle
+ de la pile est
le siège d'une réduction
(les électrons sont captés),
-
On l'appelle la
cathode.
-
L’équation de la réaction de fonctionnement de la pile est établie en combinant
des deux réactions électrochimiques aux électrodes
|
|