|
Suivi temporel d'un système chimique. |
|
|
|
|
|
|
Suivi temporel d'un système chimique. |
|
|
|
|
|
|
QCM N° 03
Suivi
temporel.
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
Dans la
transformation
modélisée par
la
réaction
d’équation :
H2O2
(aq) + 2 H+ (aq)
+ 2 I–
(aq) →
2 H2O (ℓ) + I2 (aq) |
H2O2
(aq) et
I–
(aq) sont
des oxydants |
H2O2
(aq) et
I2
(aq) sont
des oxydants |
H2O2
(aq) et
I–
(aq) sont
des réducteurs |
B |
|
2 |
Une équation de
la réaction support
du dosage du diiode
s’écrit : I2
(aq) + 2 S2O32- (aq)
→ 2 I˗
(aq) + S4O62– (aq) |
2 n
(I2, début) =
n
(S2O32–, éqv) |
n
(I2, début) =
n
(S2O32–, éqv) |
n
(I2, début) =
2 n
(S2O32–, éqv) |
A |
|
3 |
Une solution
aqueuse de chlorure de fer
III de volume V
= 1,0 L est préparée par dissolution
d’une quantité n
= 0,10 mol de chlorure de fer solide FeCℓ3
(s). Alors : |
[Fe3+] = [Cℓ–] =
0,10 mol . L–1 |
[Fe3+] = 3
[Cℓ–] =
0,30 mol . L–1 |
3
[Fe3+] = [Cℓ–] =
0,30 mol . L–1 |
C |
|
4 |
Un catalyseur
est une espèce chimique
qui : |
Modifie la
composition
finale du
système |
Modifie la
durée
d’évolution
d’une
transformation |
Remplace
le réactif
limitant |
B |
|
5 |
Soit la réaction
suivante :
H2O2
(aq) + 2 H+ (aq) +
2 I– (aq) →
2 H2O (ℓ) + I2 (aq) Un facteur
cinétique de cette réaction
est un paramètre
physique qui : |
Augmente la
quantité de
diiode formé à
l’état final |
Modifie
l’évolution
temporelle
de la
transformation |
Augmente
avec la
température. |
B |
|
6 |
L’unité usuelle
de la vitesse
volumique de consommation
d’un réactif est :
|
mol . L–1. s–1 |
m
. s–1 |
mol . h–1 |
A |
|
7 |
Le temps de
demi-réaction d’une
transformation dans certaines
conditions expérimentales
est t
½ = 20 min. Au bout de 40 min, dans les
mêmes conditions :
|
La
transformation
est toujours
terminée |
L’avancement
x
est toujours égal à xmax. |
L’avancement
vérifie
x
> xf / 2 |
C |
|
8 |
Une loi de
vitesse est dite d’ordre
1, si : |
La concentration
en quantité de
réactif est
proportionnelle
au temps |
La vitesse
volumique de
consommation
d’un réactif est
proportionnelle
au temps |
La vitesse
volumique de
consommation
d’un réactif est
proportionnelle à
sa
consommation |
C |
|
9 |
Le temps de
demi-réaction t
½ est : |
La durée
nécessaire à
la disparition
de la moitié
des réactifs |
La durée nécessaire à
la disparition
de la moitié
du réactif limitant |
La moitié du
temps nécessaire
pour que la
réaction soit
terminée |
B |
|
10 |
La trempe :
|
Est un rinçage
du mélange
réactionnel |
Désigne un
refroidissement
brutal du système |
Ralentit
l’évolution
d’un système |
BC |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
Oxydant-réducteur :
-
À tout couple oxydant / réducteur, on associe la demi-équation électronique
d’oxydoréduction suivante :
|
Ox |
+ |
n
e – |
|
Red |
-
Ox + n e – ![]() Red
Red
-
Exemple : Cu2+ (aq) + 2 e –
![]() Cu (s)
Cu (s)
-
Cu2+ (aq) est l’oxydant du couple Cu2+ (aq)
/ Cu (s)
-
Cu (s) est le réducteur du couple Cu2+ (aq) / Cu
(s)
-
Remarque :
-
L’oxydant se trouve du même côté que les électrons dans la demi-équation
électronique.
-
Ceci est une écriture formelle.
-
La double flèche traduit la possibilité de passer d’une forme à l’autre suivant
les conditions expérimentales.
-
La transformation chimique qui correspond au passage de l’oxydant Ox à
son réducteur conjugué Red est une réduction. :
-
Une réduction est un gain d’électrons.
-
La transformation chimique qui correspond au passage du réducteur Red à
son oxydant conjugué Ox est une oxydation :
-
Une oxydation est une perte d’électrons.
-
Au cours d’une réaction d’oxydoréduction, un oxydant est réduit et un réducteur
est oxydé.
Équation de la réaction :
H2O2 (aq) + 2 H+
(aq) + 2 I– (aq) → 2 H2O (ℓ) + I2
(aq)
Couples oxydant-réducteur :
-
Le peroxyde d’oxygène H2O2 (aq) (eau
oxygénée) est l’oxydant du couple H2O2 (aq)
/ H2O (ℓ)
-
Le diiode I2 (aq) est l’oxydant du couple I2
(aq) / I– (aq)
Interprétation :
|
H2O2
(aq) |
+ 2 e– |
+ 2 H+ (aq) |
|
2 H2O
(ℓ) |
|
|
|
|
2 I– (aq) |
|
I2
(aq) |
+ 2 e– |
|
H2O2
(aq) |
+ 2 H+ (aq) |
+ 2 I– (aq) |
→ |
2 H2O
(ℓ) |
+ I2 (aq) |
Dosage du diiode :
-
À l’équivalence, les réactifs ont été mélangés dans les proportions
stœchiométriques :
|
de titrage |
I2
(aq) |
+
2 S2O32–
(aq) |
→ |
2
I– (aq) + S4O62–
(aq) |
|
|
Quantités
de matières à
l’équivalence |
n
(I2,
|
n (S2O32–, éqv) |
|
|
|
|
Coefficients
stœchiométriques |
1 |
2 |
|
|
|
|
Relation |
Ou
2 n
(I2, début) = n (S2O32–,
éqv) |
|
|
|
|
-
Voir : Chap. N° 04 Titrage colorimétrique ( première)
Solution de chlorure de fer III :
-
Réaction de dissolution :
FeCℓ3 (s)
![]() Fe3+ (aq) +3
Cℓ – (aq)
Fe3+ (aq) +3
Cℓ – (aq)
|
|
FeCℓ3
(s) |
→ |
Fe3+
(aq) |
3
Cℓ
–
(aq) |
|
Quantités de matière Avant dilution |
n |
|
0 |
0 |
|
Quantités de matière Après dilution |
0 |
|
n |
3
n |
|
Concentrations |
|
|
|
|
|
Solution mol . L–1
|
C
= 0,10 |
|
[Fe
3+]
=
C = 0,10 |
[Cl
–]
= |
Catalyseur :
-
Un catalyseur est une espèce chimique qui accélère une réaction chimique.
-
Au cours de la transformation, il est consommé puis régénéré.
-
En conséquence, sa formule n’apparaît pas dans l’équation de la réaction.
-
Il n‘agit pas sur la limite de la réaction chimique (si celle-ci est limitée).
Les facteurs cinétiques :
-
La concentration des réactifs est un facteur cinétique.
-
La vitesse de disparition d'un réactif ou de formation d'un produit augmente
généralement avec la concentration des réactifs.
-
La température d'un mélange réactionnel est un facteur
cinétique.
-
La vitesse de formation ou de disparition d'un corps
augmente généralement avec la température.
Vitesses volumiques :
►
Vitesse volumique d’apparition d’un produit P :
-
La vitesse vapp (P)t
d’apparition ,d’un produit P, est égale à la dérivée par rapport
au temps de sa concentration :
-
![]()
►
Vitesse volumique de disparition d’un réactif R :
-
La vitesse vdisp (R)t
de disparition, d’un réactif R, est égale à l’opposé de la dérivée
par rapport au temps de sa concentration :
-
![]()
►
Vitesse volumique et unités :
-
La vitesse volumique peut s’exprimer en mol . L–1 . s–1
-
On peut utiliser aussi : mol . L–1 . min–1
Loi des vitesses d’ordre 1 :
-
Considérons la réaction chimique suivante :
a A +
b B → c C + d D
-
Une réaction chimique est d’ordre 1 par rapport au réactif A,
-
si lorsque le réactif B est en large excès,
-
les vitesses volumiques de disparition des réactifs
-
ou d’apparition des produits sont proportionnelles à la
-
concentration [A]t de l’espèce A au cours du temps :
-
Ainsi, on peut écrire :
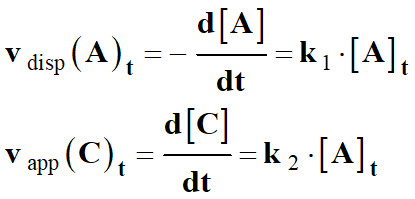
Temps de demi-réaction :
-
Le temps de demi-réaction t1/2 d’un système chimique est la
durée au bout de laquelle la moitié du réactif limitant a été consommé.
-
À la date t = 0, la concentration initiale du réactif A est [A]0.
-
Le temps de demi-réaction t1/2 est la date pour laquelle :
-
![]()
-
Détermination graphique :
La trempe :
-
Elle désigne le refroidissement brutal d’un milieu réactionnel pour le rendre
cinétiquement inerte.
-
On utilise ce procédé lors de dosages en séances de travaux pratiques pour
arrêter la réaction à un instant donné t.
-
Si le refroidissement est assez rapide, le système n’évolue plus et conserve la
composition qu’il avait juste avant le refroidissement.
-
D’autre part, pour ralentir les réactions indésirables, on place les aliments au
réfrigérateur ou au congélateur.
|
|