|
Dosage par titrage |
|
|
|
|
|
|
QCM N° 03
Dosage par
titrage
Pour chaque
question, indiquer la (ou les) bonne(s) réponse(s). |
|||||
|
|
Énoncé |
A |
B |
C |
R |
|
1 |
On veut
préparer un volume
V
= 200,0 mL d’une solution
d’hydroxyde de
sodium de
concentration
apportée
c
= 1,00 mol . L–1.
Pour préparer
cette solution
par
dissolution, il faut utiliser :
Donnée :
Masse molaire de
l’hydroxyde de
sodium :
M
= 40,0 g . mol–1 |
Une fiole
jaugée de
200,0 mL |
Une éprouvette
graduée de
200 mL |
Une burette
graduée de
200 mL |
A |
|
2 |
On veut
préparer un volume
V
= 200,0 mL d’une solution
d’hydroxyde de
sodium de
concentration
apportée
c
= 1,00 mol . L–1.
Pour préparer
cette solution
par
dissolution, il faut peser
une masse
d’hydroxyde de
sodium
Donnée :
Masse molaire de
l’hydroxyde de
sodium :
M
= 40,0 g . mol–1 |
m
= 8 g |
m
= 5,00 g |
m
= 8,00 g |
C |
|
3 |
On veut
préparer un volume
V
= 200,0 mL d’une solution
d’hydroxyde de
sodium de
concentration
apportée
c
= 1,00 mol . L–1.
Pour préparer
cette solution
par dilution
d’une solution
mère de
concentration
c0
= 20,0 mol . L–1, il faut
prélever un
volume de
solution
mère : |
V’
= 10,0 mL |
V’
= 100,0 mL |
V’
= 8,0 mL |
A |
|
4 |
La
demi-équation du couple
H2O
(ℓ) / HO– (aq) est : |
H2O
(ℓ) + H+
= HO–
(aq) |
HO–
(aq) + H+
= H2O
(ℓ) |
H2O
(ℓ)
= HO–
(aq) + H+ |
BC |
|
5 |
Les couples
acide / base
de l’eau
sont : |
H2O
(ℓ) / H3O+ (aq)
Et
H2O
(ℓ) / HO– (aq) |
H3O+
(aq) / H2O (ℓ)
Et
HO–
(aq) / H2O (ℓ) |
H3O+
(aq) / H2O (ℓ)
Et
H2O
(ℓ) / HO– (aq) |
C |
|
6 |
Soient les
couples
NH4+
(aq) / NH3 (aq)
et H2O
(ℓ) / HO– (aq).
On peut
envisager
les
réactions : |
NH4+(aq)
+ H2O(ℓ)
=
HO–(aq)
+ NH3(aq) |
NH4+(aq)
+ HO–(aq)
=
NH3
(aq) + H2O (ℓ) |
NH3
(aq) + H2O (ℓ)
=
NH4+(aq)
+ HO–(aq) |
BC |
|
7 |
On considère
une solution
d’hydroxyde de
sodium
(Na+
(aq) + HO– (aq))
On mesure la
conductance
G
= 9,64 × 10–4 S avec une
cellule de
constante 90 m–1.
La
conductivité est : |
1,07 × 10–5
S . m–1 |
8,68× 10–2
S . m–1 |
8,68× 10–5
S . m–1 |
B |
|
8 |
On considère
une solution
d’hydroxyde de
sodium
(Na+
(aq) + HO– (aq))
Si la
conductivité de la
solution est
σ
= 8,68× 10–2 S . m–1,
sa
concentration est :
Données :
λ
(HO–)=19,8×10–3
λ
(Na+) = 5,0×10–3 |
3,50 × 10–3
mol . L–1 |
3,50
mol . L–1 |
3,50
mol . m–3 |
AC |
|
9 |
On considère
une solution
d’hydroxyde de
sodium
(Na+
(aq) + HO– (aq)) La conductivité d’une solution en concentration
apportée
c
= 1,00 × 10–2 mol . L–1
est :
Données :
λ
(HO–)=19,8×10–3
λ (Na+) = 5,0×10–3 |
2,48 × 10–4
S . m–1 |
2,48 × 10–1
S . m–1 |
2,48 × 102
S . m–1 |
B |
|
10 |
On verse dans un erlenmeyer
un volume VA
d’une solution contenant l’espèce chimique
A de
concentration cA. On y ajoute progressivement une solution contenant l’espèce B de concentration cB connue. L’équation de la
réaction
support du titrage est :
3 A +
B → C + 2 D De toutes les espèces,
seule B
est colorée.
Le volume
équivalent est VE.
Pour ce
titrage, A est : |
La solution
titrée |
Le réactif
titrée |
Le réactif
titrant |
B |
|
11 |
On verse dans un erlenmeyer
un volume VA
d’une solution contenant l’espèce chimique
A de
concentration cA. On y ajoute progressivement une solution contenant l’espèce B de concentration cB connue. L’équation de la réaction support du
titrage est :
3 A +
B → C + 2 D De toutes les espèces, seule
B est
colorée.
Le volume
équivalent est VE.
La solution
contenant B est
initialement
placée : |
Dans un
erlenmeyer |
Dans une
burette
graduée |
Sur agitation
magnétique |
B |
|
12 |
On verse dans un erlenmeyer
un volume VA
d’une solution contenant l’espèce chimique
A de
concentration cA. On y ajoute progressivement une solution contenant l’espèce B de concentration cB connue. L’équation de la
réaction
support du titrage est :
3 A +
B → C + 2 D De toutes les espèces,
seule B
est colorée.
Le volume
équivalent est VE.
L’équivalence
est repérée par : |
La disparition
de la couleur
de A |
La disparition
de la couleur
de B |
La persistance
de la couleur
de B |
C |
|
13 |
On verse dans
un erlenmeyer
un volume VA
d’une solution contenant l’espèce chimique
A de
concentration cA.
On y ajoute
progressivement
une solution
contenant
l’espèce B
de concentration
cB
connue.
L’équation de
la réaction
Support du
titrage est :
3 A +
B → C + 2 D
De toutes les
espèces,
seule B
est colorée.
Le volume
équivalent est VE.
La
concentration de A dans
la solution
titrée vérifie : |
|
|
|
C |
QCM réalisé avec le logiciel Questy
Pour s’auto-évaluer
La dissolution :
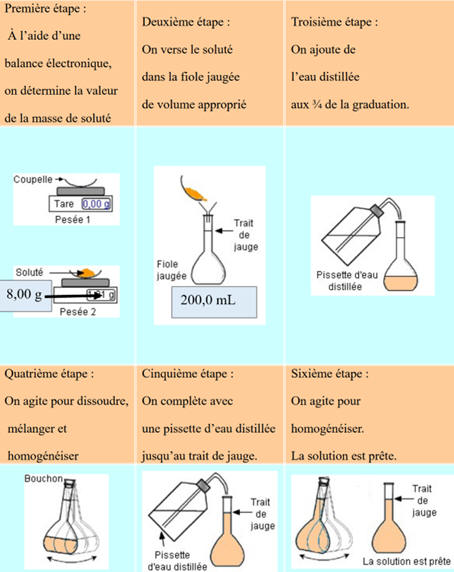
Préparation par dilution :
|
SM |
{ |
CM = |
Dilution |
SF |
{ |
CF = |
|
VM = ? |
→ |
VF = |
||||
|
nM = CM . VM |
|
nF = CF . VF |
||||
|
Solution mère |
nM = nF |
Solution fille |
||||
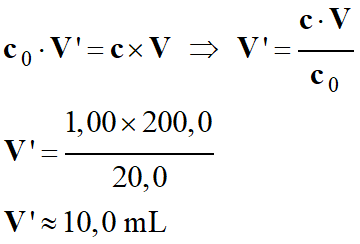
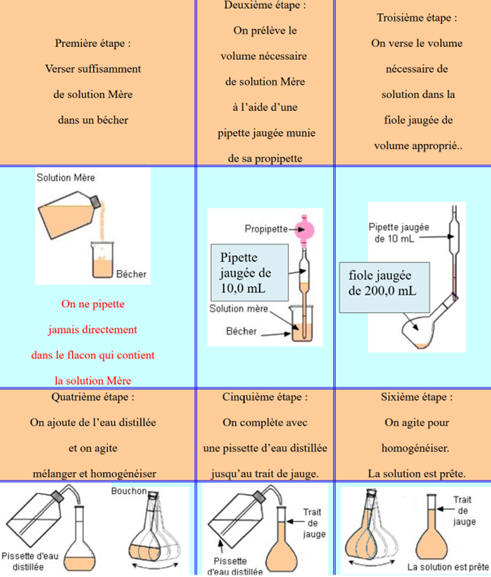
Couples acide/base : La notation AH / A–
|
AH
(aq) |
|
A–
(aq) |
+ |
H+ |
|
Acide |
|
Base |
|
ion hydrogène |
|
AH (aq) |
→ |
A–
(aq) |
+ |
H+ |
|
Ou
bien |
||||
|
A–
(aq) + H+
|
→ |
AH (aq) |
|
|
Espèce amphotère.
Réaction acido-basique :
 H + + A1–
H + + A1–  H + + A2–
H + + A2– A1H
+ A2–
![]() A1–
+ A2H
A1–
+ A2H
Autre cas
A1H
+ A2–
→ A1–
+ A2H
|
NH3
(aq) +
H+ |
|
NH4+
(aq) |
|
|
|
|
|
H2O
(ℓ) |
|
HO–
(aq) +
H+
|
|
|
|
|
|
NH3
(aq + ) +
H2O
(ℓ) |
|
NH4+
(aq) +
HO–
(aq) |
Autre cas
|
NH4+
(aq) |
|
NH3
(aq) +
H+ |
|
|
|
|
|
HO–
(aq) +
H+
|
|
H2O
(ℓ) |
|
|
|
|
|
NH4+
(aq) +
HO–
(aq) |
|
NH3
(aq) +
H2O
(ℓ) |
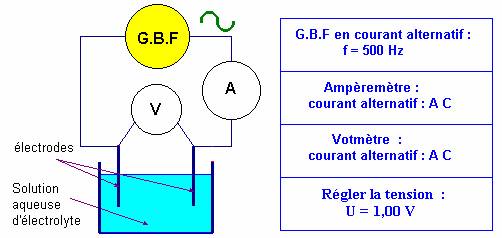
Mesure de la conductance :
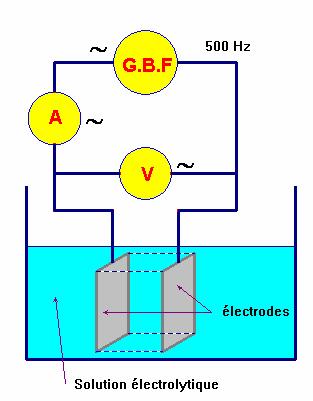
|
|
G
est la conductance en siemens S |
|
S :
surface des électrodes en m2. |
|
|
ℓ :
distance entre les électrodes en m. |
|
|
σ :
conductivité de la solution en S . m–
1 |
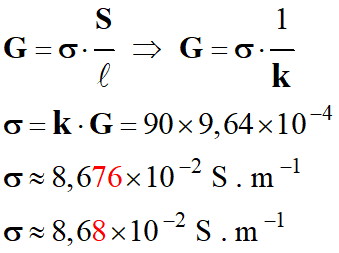 .
.La conductivité et la concentration :

|
|
eau |
|
|
|
|
NaOH (s) |
→ |
Na+
(aq) |
+ |
HO–
(aq) |
|
n |
|
0 |
|
0 |
|
0 |
|
n
/ V |
|
n
/ V |
|
|
|
C |
|
C |
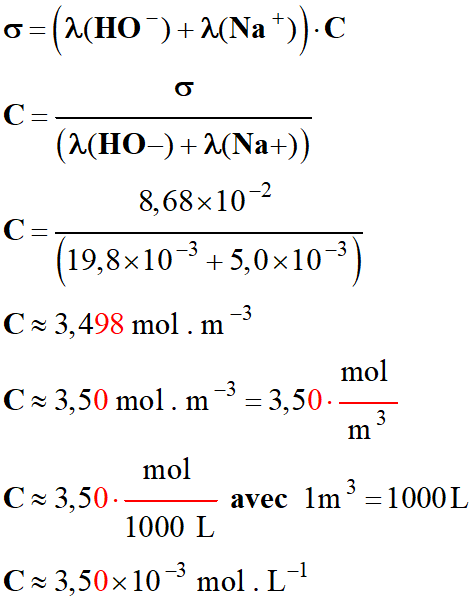
|
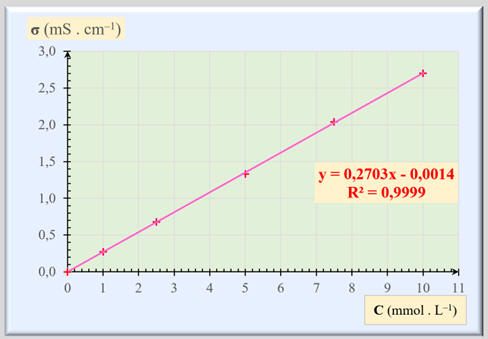
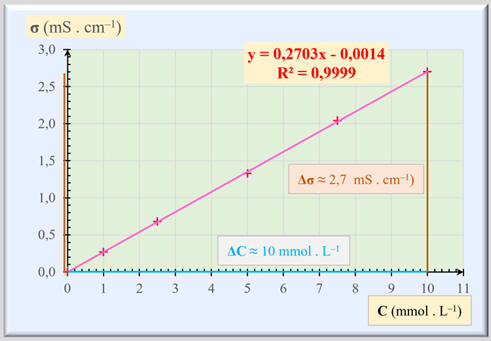
La conductivité σ d’une solution diluée d’une espèce ionique dissoute est
proportionnelle à sa concentration molaire C en soluté apporté : |
|
σ
= k . C |
|
σ
= k . C |
C ;
concentration en mol . L– 1 |
|
k :
coefficient de proportionnalité en S . L
. m– 1. mol– 1 |
|
|
σ :
conductivité de la solution en S . m–
1 |
|
|
|
Conductivité d’une solution ionique :
|
|
eau |
|
|
|
|
NaOH (s) |
→ |
Na+
(aq) |
+ |
HO–
(aq) |
|
n |
|
0 |
|
0 |
|
0 |
|
n
/ V |
|
n
/ V |
|
|
|
C |
|
C |
|
La conductivité
σ d’une solution diluée d’une espèce ionique dissoute est
proportionnelle à sa concentration molaire C en soluté apporté : |
|
σ
= k . C |
|
σ
= k . C |
C ;
concentration en mol . L– 1 |
|
k :
coefficient de proportionnalité en S . L
. m– 1. mol– 1 |
|
|
σ :
conductivité de la solution en S . m–
1 |
Le conductimètre :
|
Le
conductimètre est constitué : - D'une sonde de conductimétrie (deux plaques conductrices en vis-à-vis,
alimentées par une tension alternative).
-
D'un
boîtier qui sert d'alimentation pour la sonde. - Ce boîtier dispose en outre d'une zone de lecture, d'un bouton
de réglage
de la
température et d'un bouton d'étalonnage.
-
Un
troisième bouton permet en général de sélectionner le calibre. |
Titrage conductimétrique :
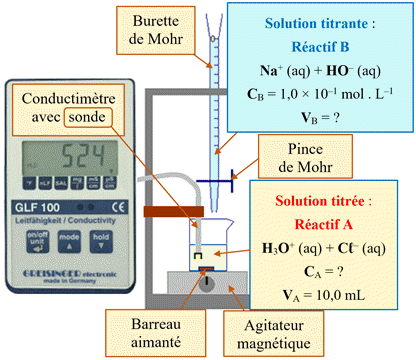
Exemple :
Suivi par conductimétrie
|
Titrer une espèce
chimique en solution, c’est déterminer sa
concentration molaire dans la solution |
|
Le but du titrage
ou d’un dosage est de déterminer la concentration
molaire d’une espèce chimique M présente dans un volume
donné et précis d’une solution. L’outil de
détermination de cette quantité de matière est la réaction
chimique : C’est la réaction
de dosage ou de titrage. Cette réaction doit
être rapide, totale, spécifique et unique. |
Équivalence d’un titrage :
|
Équivalence d’un titrage : À l’équivalence,
les réactifs sont dans les proportions stœchiométriques définies
par les
coefficients de la réaction. À l’équivalence, il n’y a pas de
réactif limitant. |
|
Avant l’équivalence |
|
Le
réactif titrant
est totalement consommé, c’est le
réactif limitant Il reste encore du
réactif titré :
il est en excès. |
|
À
l’équivalence : |
|
Le
réactif titrant
et le
réactif titré
sont totalement consommés. Ils sont tous
les deux limitants (mélange
stœchiométrique). |
|
Après
l’équivalence |
|
Le
réactif titré
est totalement consommé : c’est
le réactif limitant. Maintenant, c’est
le réactif titrant
qui est en
excès. |
|
En conclusion |
|
À l’équivalence
du titrage, il y a changement de réactif limitant |
La détermination de la concentration du réactif titré :
Repérage de l’équivalence :
Relation à l’équivalence :
3 A +
B → C + 2 D
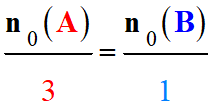
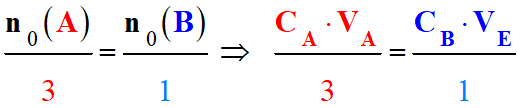
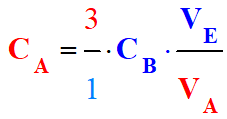
3 A +
B → C + 2 D
|
Équation |
3
A |
+ |
B |
→ |
|
Quantité de matière |
n
(A) |
|
n
(B) |
|
|
Coefficients
stœchiométriques |
3 |
|
1 |
|
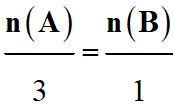
|
|