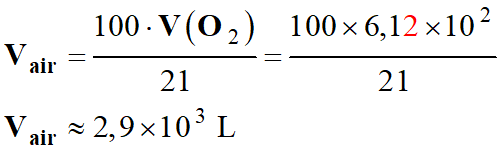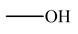|
Transformation chimique |
|
|
|
|
|
|
D.S. : Cheminée au bioéthanol (20 min)
|
|
Cheminée au bioéthanol (20 min) : 1.
Combustion de l’éthanol dans l’air :
-
Une transformation est exothermique si le
système chimique libère de l’énergie vers le milieu extérieur.
-
La combustion de l’éthanol dans l’air est
exothermique (on se sert de cette réaction pour se chauffer). 2.
Équation de la réaction de combustion complète
de l’éthanol.
- Le fonctionnement de la cheminée pendant une heure consomme 8,5 mol d’éthanol.
-
n
(C2H6O) = 8,5 mol
-
La quantité d’éthanol qui réagit n
(C2H6O) est égale au tiers de
la quantité de dioxygène qui réagit n (O2)
-
On écrit :
-
-
On tire de ceci que :
-
n (O2) = 3
n
(C2H6O) = 3 × 8,5
-
n (O2) ≈ 25,5
mol
-
n (O2) ≈ 26 mol 4.
Volume de dioxygène
O2 (g) et d’air : a.
Volume de dioxygène consommé par une heure de fonctionnement de la cheminée. - 1 mol de dioxygène O2 (g) occupe un volume de VM = 24 L à 25 ° C :
-
V (O2) = n
(O2) . VM
-
V (O2) ≈ 25,5
× 24
-
V (O2) ≈ 6,12
× 102 L
-
V (O2) ≈ 6,1
× 102 L b.
Valeur du volume d’air correspondant.
-
L’air est un mélange gazeux, il est
composé principalement
-
De diazote (78 %)
-
De dioxygène (21 %)
-
Il contient aussi les gaz suivants (total
≈ 1 %)
-
Volume d’air correspondant :
-
c.
Installer ce type de cheminée dans une grande
pièce bien ventilée :
-
La combustion de l’éthanol nécessite une
grande quantité de dioxygène, donc d’air.
-
Il faut renouveler l’air de la pièce pour
obtenir une combustion complète.
-
Il faut une grande pièce et il faut
ventiler la pièce. |
|||||||||||||||||||||||||||
|
L’essence de wintergreen (20 min) : 1.
États physiques de l’acide salicylique et du
méthanol : - À 25 ° C, le méthanol est à l’état liquide (θfus = – 96 ° C et θéb = 65
° C) - À 25 ° C, l’acide salicylique est à l’état solide (θfus = 159 ° C et θéb
= 211 ° C)
-
Étape 1 : Obtention des réactifs et
préparation du mélange réactionnel.
-
Étape 2 : Réalisation de la réaction
chimique
-
Étape 3 : Extraction du produit.
-
Étape 4 : Identification du produit. 3.
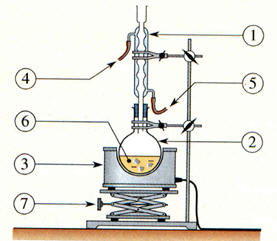
Le montage : a.
Schéma légendé du chauffage à reflux.
-
Le chauffage à reflux permet :
-
De travailler à une température élevée,
-
D’accélérer la synthèse de l’espèce
chimique,
-
D’éviter les pertes de réactifs et de
produits. 4.
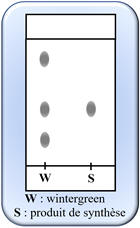
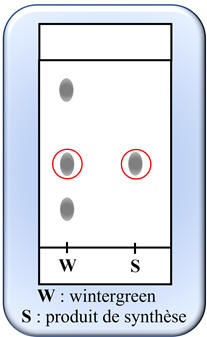
Étude du chromatogramme :
- L’espèce synthétisée S est une espèce pure. - On
observe une seule tache. - L’essence de wintergreen est un mélange. - On observe trois taches sur le chromatogramme.
-
L’espèce synthétisée est identique à une
des espèces chimiques présentes dans l’essence de wintergreen.
-
On observe que la tache du produit de
synthèse est à la même hauteur que l’une des taches de l’essence de
wintergreen. |
|
-
Additif :
- Pictogrammes :
-
Le méthanol ou alcool de bois que l'on
peut retrouver dans les alcools frelatés.
-
Il provoque la cécité et la mort.
-
Le méthanol
est un alcool.
-
L’éthanol est un alcool (alcool
éthylique).
-
C’est l’alcool que l'on retrouve dans les
boissons alcoolisées.
-
Des petites quantités d'éthanol
provoquent un état euphorique.
-
Des doses plus importantes dépriment
gravement le système nerveux :
-
à
consommer avec modération !
-
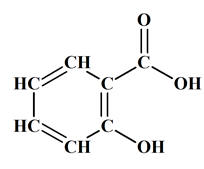
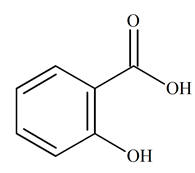
L’acide salicylique est un acide
carboxylique. - On prépare l'aspirine à partir de l'acide salicylique qui porte un groupement – OH
(fixé sur le cycle benzénique) et peut, comme un alcool, subir une estérification.
-
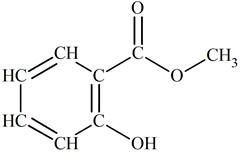
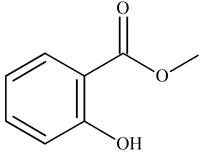
Le Salicylate de méthyle est un ester (2-hydroxybenzoate de méthyle).
|
|
|