|
Vers les entités chimiques stables. Cours |
|
|
|
|
|
|
a)- Exercice 5 page 78 : Déterminer un numéro
atomique. b)- Exercice 6 page 78 : Dénombrer les électrons
de valence. c)- Exercice 7 page 78 : reconnaitre les
électrons de valence. d)- Exercice 8 page 78 : dénombre les électrons de valence à l’aide du tableau périodique. e)- Exercice 11 page 79 : Identifier un élément chimique à partir de sa position dans le tableau
périodique. f)- Exercice 12 page 79 : Reconnaitre les éléments d’une même famille. g)- Exercice 16 page 79 : Prévoir la charge d’un
ion. h)- Exercice 17 page 79 : Utiliser la charge
d’un ion. |
|
QCM réalisé avec Questy pour s'auto-évaluer
Configuration électronique d’un
atome.
Tableau périodique des
éléments.
Entités chimiquement stables. |
I- La configuration électronique
d’un atome.
-
Les Z
électrons d’un atome se répartissent en couches électroniques
-
Notées
n =
1,2,3,
…
-
Ces couches électroniques sont
elles-mêmes composées d’une ou plusieurs sous-couches :
-
Notées : s, p, d, f
-
Chaque sous-couche contient un nombre
limité d’électrons.
-
Couche :
n =
1 :
Première période
-
Elle comprend la sous-couche1s
que l’on représente avec un carré : ![]()
-
La sous-couche
s peut contenir au
maximum 2 électrons
-
La couche
n = 2
-
Elle comprend la sous-couche 2s,
et la sous-couche 2p
-
La sous-couche
p contient au
maximum 6 électrons
-
Représentation : 
3)- Le remplissage des
différentes couches.
-
La configuration électronique d’un
atome à l’état fondamental décrit la répartition de ses électrons dans les
différentes sous-couches.
-
Les électrons se répartissent dans les
sous-couches selon un ordre déterminé :
-
Pour la classe de seconde :
1s
→
2s →2p
→3s
→3p,
etc.
-
Lorsqu’une sous-couche est saturée, les
électrons restants occupent la sous-couche suivante, puis, si nécessaire, celle
d’après.
4)- Exemple : configuration
électronique de l’aluminium, Z
= 13, à l’état fondamental
-
1s2
2s2
2p6 3s2 3p1
-
Il y a 2 électrons sur la couche
1s
-
Les couches
1
et
2
sont saturées.
-
La couche
n
= 3 est la dernière couche occupée.
-
On arrête le remplissage une fois que
les électrons ont été placés.
5)-
Couche électronique de valence.
-
Pour
Z ≤ 18, les électrons de valence sont ceux qui
occupent la couche électronique de nombre n
le plus élevé.
-
Cette dernière est appelée couche
électronique de valence, sa configuration électronique se nomme configuration
électronique de valence.
-
Exemples :
-
Pour l’atome de silicium
Si,
Z = 14,
-
Sa configuration électronique est :
1s2
2s2 2p6
3s2 3p2
-
Sa configuration électronique de
valence est :
3s2
3p2
-
Pour l’atome d’aluminium
Al,
Z = 13,
-
Sa configuration électronique est :
1s2
2s2 2p6
3s2 3p1
-
Sa configuration électronique de
valence est :
3s2
3p1
-
Remarque : Les électrons de valence
d’un atome sont responsables de sa réactivité chimique.
II- Le tableau périodique des éléments
chimiques.
-
La classification périodique comporte
18 colonnes et 7 lignes ou périodes.
-
Les éléments sont classés par numéro
atomique Z
croissant.
-
On retrouve dans la classification
périodique le remplissage progressif des couches électroniques.
-
Les éléments dont les atomes ont le
même nombre d’électrons sur la couche électronique externe sont disposés dans
une même colonne et constituent une famille.
2)- Les trois premières
périodes :
-
La première période :
elle
correspond au remplissage de la couche électronique
n
= 1.
-
Soit la sous-couche
1s
qui est saturé à 2 électrons.
-
Elle comprend 2 éléments (H
et He)
-
La deuxième
période :
elle
correspond au remplissage de la couche électronique
n
= 2.
-
Soit la sous-couche
2s
(saturé à 2 électrons) et
2p
(saturé à 6 électrons)
-
Elle comprend 8 éléments (Li,
Be, – 10 cases vides –B,
C, N, O, F, Ne)
-
La troisième
période :
elle
correspond au remplissage de la couche électronique
n
= 3.
-
Soit la sous-couche
3s
(saturé à 2 électrons) et
3p
(saturé à 6 électrons)
-
Elle comprend 8 éléments (Na,
Mg, – 10 cases vides –,
Al, Si, P, S, Cℓ, Ar)
3)- Tableau périodique
simplifié :
|
1 |
|
|
|
|
|
|
18 |
|
H 1s1 |
2 |
13 |
14 |
15 |
16 |
17 |
He 1s2 |
|
Li …2s1 |
Be …2s2 |
B …2s22p1 |
C …2s22p2 |
N …2s22p3 |
O …2s22p4 |
F …2s22p5 |
Ne …2s22p6 |
|
Na …3s1 |
Mg …3s2 |
Al …3s23p1 |
Si …3s23p2 |
P …3s23p3 |
S …3s23p4 |
Cl …3s23p5 |
Ar …3s23p6 |
-
Dans le tableau simplifié, on ne fait
apparaître que la couche électronique externe.
-
Dans le tableau périodique simplifié,
deux blocs se distinguent :
-
Le bloc s :
il correspond au remplissage des
sous-couches s
(colonnes 1 et 2)
-
Le bloc p :
il correspond au remplissage des
sous-couches p
(colonnes 13 à 18)
-
Les éléments d’une même colonne ont des
propriétés chimiques communes et constituent une même famille.
-
Les éléments de la colonne 18 (Hélium,
He, néon Ne, argon, Ar) constituent la famille des gaz nobles.
-
Remarque : L’hélium,
He, de
configuration
1s2,
est une exception.
-
Il est placé dans le
bloc p
car ses propriétés chimiques sont celles d’un gaz noble.
4)- Position d’un élément
dans le tableau périodique.
- Pour déterminer la ligne (ou période) et la colonne (ou famille) auxquelles un élément appartient,
il faut repérer le numéro de la couche de valence et
le nombre d’électrons de valence.
-
Exemple : Soit l’atome de phosphore,
P,
Z = 15.
-
Déterminer sa position (ligne et
colonne) dans la classification périodique.
-
On détermine dans un premier la
configuration électronique de l’atome de phosphore
P.
-
Il faut placer 15 électrons sur les
différentes couches et sous-couches :
-
1s2
2s2 2p6
3s2 3p3
-
Le nombre
n le plus grand est
n
= 3 : l’élément est placé dans la 3e
période.
-
D’autre part, l’élément possède 3
électrons sur la couche 3p (3p3).
-
L’élément est donc dans la 3e
colonne du bloc
p
qui commence à la colonne 13.
-
Il est dans la 15e colonne.
-
En résumé, l’élément phosphore
P est placé à la 3e
période et à la 15e colonne du tableau périodique.
|
1 |
|
|
|
|
|
|
18 |
|
H 1s1 |
2 |
13 |
14 |
15 |
16 |
17 |
He 1s2 |
|
Li …2s1 |
Be …2s2 |
B …2s22p1 |
C …2s22p2 |
N …2s22p3 |
O …2s22p4 |
F …2s22p5 |
Ne …2s22p6 |
|
Na …3s1 |
Mg …3s2 |
Al …3s23p1 |
Si …3s23p2 |
P …3s23p3 |
S …3s23p4 |
Cl …3s23p5 |
Ar …3s23p6 |
III-
Les entités stables
chimiquement.
-
Les gaz nobles (hélium,
He,
néon, Ne, argon,
Ar, ….) possèdent une
stabilité énergétique remarquable.
-
Ils réagissent très rarement avec
d’autres éléments.
-
Leur configuration électronique de
valence est de la forme ns2 np6.
-
Ou dans le cas de l’hélium, 1s2.
-
Un atome d’hélium possède 2 électrons
sur sa couche de valence (duet).
-
Un atome de néon et un atome d’argon
possèdent 8 électrons sur la couche de valence (octet).
-
Règle de stabilité :
-
Au cours des transformations chimiques,
les atomes tendent à acquérir la même configuration électronique que celle d’un
gaz noble,
-
C’est-à-dire une configuration
électronique de valence en duet ou en octet.
-
Pour obtenir une configuration
électronique stable, les atomes forment :
-
Des ions
-
Ou des molécules.
2)- Formation d’ions
monoatomiques.
- Pour obtenir la même configuration électronique que celle du gaz noble le plus proche,
les atomes peuvent gagner ou
perdre un ou plusieurs électrons afin de former des ions monoatomiques stables.
-
Ainsi, l’atome d’aluminium
Aℓ, Z
= 13,
perd 3 électrons pour obtenir la configuration
électronique du néon.
-
Configuration électronique de l’atome
d’aluminium :
1s2
2s2
2p6
3s2 3p1
-
Configuration électronique de l’ion
Aℓ3+ :
1s2
2s2 2p6
-
Configuration électronique du néon
Ne :
1s2
2s2 2p6
-
Un atome de soufre
S,
Z = 16, gagne 2
électrons pour obtenir la configuration électronique de l’argon, le gaz noble le
plus proche.
-
Configuration électronique de l’atome
de soufre :
1s2
2s2
2p6
3s2 3p4
-
Configuration électronique de l’ion
sulfure S2– :
1s2
2s2 2p6
3s2
3p6
- Configuration électronique de l’argon Ar : 1s2 2s2 2p6 3s2 3p6
-
Remarques :
-
La charge de l’ion dépend du numéro de
la colonne dans laquelle se trouve l’élément dans le tableau périodique.
-
Les atomes des éléments d’un même
colonne du tableau périodique forment des ions monoatomiques de même charge.
-
Tableau de quelques ions à connaître :
|
Formule |
Nom |
|
H+ |
Ion hydrogène |
|
Na+ |
Ion sodium |
|
K+ |
Ion potassium |
|
Ca2+ |
Ion calcium |
|
Mg2+ |
Ion magnésium |
|
F– |
Ion fluorure |
|
S2– |
Ion sulfure |
|
Cl– |
Ion chlorure |
3)- Formulation
des molécules.
a)- Schéma de Lewis d’une molécule.
-
Le schéma de Lewis d’une molécule est
une modélisation de l’enchaînement des atomes de la molécule :
-
Chaque atome est représenté par son
symbole ;
-
Les électrons de valence sont
regroupés :
-
en doublet(s) liants(s)
-
ou en doublet(s) non-liant(s)
-
représentés par des tirets.
-
Un doublet correspond à 2 électrons
b)- La liaison covalente :
-
La liaison covalente entre deux atomes
A et
B résulte de la
mise en commun de deux électrons pour former un doublet liant.
-
La liaison covalente consiste en la
mise en commun par deux atomes d’une ou plusieurs paires d’électrons, appelées
doublets de liaisons.
-
La liaison covalente est simple, double
ou triple selon que les atomes ont un, deux ou trois doublets d’électrons en
communs.
-
Le nombre de doublets qu’un atome
partage avec ses voisins est sa covalence.
-
En formant des liaisons de covalence,
chaque atome acquiert, en général, une structure électronique en octet (ou en
duet), semblable à celle du gaz noble le plus proche dans la classification
périodique.
-
Grâce à cette liaison covalente, on
obtient des édifices plus ou moins complexes appelés molécules.
c)- Les molécules.
-
Une molécule est une entité chimique
électriquement neutre, formée d’un nombre limité d’atomes liés entre eux par des
liaisons de covalence.
-
Le nombre d’atomes d’une molécule est
son atomicité.
-
Dans la formule d’une molécule, les
symboles des éléments présents dans la molécule sont écrits côte à côte avec, en
indice, en bas à droite, le nombre d’atomes de chaque élément.
-
L’indice 1 n’est jamais spécifié.
-
Dans une molécule, les atomes se lient
par des liaisons covalentes obtenues par la mise en commun de deux électrons
(doublet liant).
-
Chacun des atomes possède une
configuration électronique semblable à celle du gaz noble le plus proche.
-
Les électrons des liaisons
appartiennent aux deux atomes.
-
Les électrons des doublets non liants
appartiennent uniquement à l’atome sur lequel ils sont situés.
d)- Schéma de Lewis d’une molécule.
-
Le schéma de LEWIS précise
l’enchaînement des atomes et la position des doublets liants et non liants.
-
Dans le schéma de LEWIS d’une
molécule :
-
Le symbole de l’élément représente le
noyau de l’atome et les électrons internes,
-
Chaque doublet d’électrons externes est
figuré par un tiret.
-
On
distingue les doublets liants et les doublets non liants :
-
Un doublet liant est représenté par un
tiret entre les symboles de deux atomes,
-
Un doublet non liant est représenté par
un tiret situé autour du symbole d’un atome auquel il appartient.
-
Une liaison simple est notée
A –
B, une liaison
double A =
B et une
liaison triple A
≡ B.
-
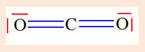
Application : Schéma de Lewis de la
molécule de CO2.
-
Configuration électronique de l’atome
d’oxygène :
1s22s22p4
-
Il possède 6 électrons sur sa couche
électronique de valence (2s22p4)
-
Il peut mettre en commun 2 électrons
pour acquérir une configuration électronique de valence en octet.
-
Configuration électronique de carbone :
1s22s22p2
-
Il possède 4 électrons sur sa couche
électronique de valence (2s22p2)
-
Il peut mettre en commun 4 électrons
pour acquérir une configuration électronique de valence en octet.
-
Chaque atome d’oxygène va mettre en
commun deux électrons avec l’atome de carbone.
-
Chaque atome d’oxygène est doublement
lié à l’atome de carbone.
-
Chaque atome respecte ainsi la règle de
l’octet.
 ou
ou 
e)- Énergie de liaison.
-
L’énergie de liaison d’une liaison
covalente A – B
correspond à l’énergie nécessaire pour rompre la liaison et reformer les atomes
isolés A et
B.
-
En se liant par une liaison covalente,
deux atomes gagent en stabilité énergétique.
-
La molécule de dihydrogène
H2 est
plus stable énergétiquement que les deux atomes d’hydrogène isolés
H.
-
Schéma énergétique :

f)- Nombre d’électrons de valence d’une
molécule :
-
Le nombre d’électrons de valence
Nv
d’une molécule est égal à la somme des nombres d’électrons de valence de tous
les atomes qui constituent la molécule.
-
Exemple : cas de la molécule d’eau :
H2O
-
Nombre
d’électrons de valence de la molécule d’eau :
- La molécule d’eau est constituée de 2 atomes d’hydrogène H et un atome d’oxygène O
-
Nombre d’électrons de valence de chaque
atome :
-
Atome d’hydrogène :
Z = 1
-
Configuration électronique :
1s1
-
Configuration électronique de valence :
1s1
-
L’atome d’hydrogène possède 1 électron
de valence
-
Atome d’oxygène : Z
= 8
-
Configuration électronique :
1s2
2s2 2p4
-
Configuration électronique de valence :
2s2
2p4
-
L’atome d’oxygène possède 6 électrons
de valence.
-
Nombre d’électrons de valence de la
molécule d’eau :
-
Nv
= 2 × 1 + 1 × 6
-
Nv
= 8
-
Cohérence avec le schéma de Lewis de la
molécule d’eau :
-
Schéma de Lewis de la molécule :
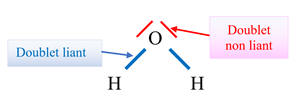
-
Dans la molécule d’eau, on dénombre :
-
2
doublets liants
(─)
et
2
doublets non liants
(─)
-
Nv
= 2 × 2 + 2 × 2
-
Nv
= 8
-
Le nombre d’électrons de valence de la
molécule d’eau est bien en accord avec le schéma de Lewis de la molécule.
1)- Schéma de Lewis de
quelques molécules.
-
Molécule d’eau
H2O,
molécule de méthanol CH3OH,
-
Molécule de sulfure de dihydrogène
H2S,
-
Molécule d’ammoniac
NH3,
méthylamine CH3NH2.
a)- Schéma de Lewis de la molécule d’eau :
-
Configuration électronique de l’atome
d’hydrogène : 1s1
-
Il possède 1 électron sur sa couche
électronique de valence.
-
Il peut mettre en commun cet électron
pour acquérir une configuration électronique de valence en duet.
-
Configuration électronique de l’atome
d’oxygène : 1s22s22p4
-
Il possède 6 électrons sur sa couche
électronique de valence (2s22p4)
-
Il peut mettre en commun 2 électrons
pour acquérir une configuration électronique de valence en octet.

-
Chaque atome d’hydrogène possède un
doublet liant (2 électrons), règle du DUET.
-
L’atome d’oxygène possède 2 doublets
liants et 2 doublets non liants, 8 électrons, règle de L’OCTET
b)- Schéma de Lewis de la
molécule de méthanol CH3OH :
-
Configuration électronique de l’atome
d’hydrogène : 1s1
-
Il possède 1 électron sur sa couche
électronique de valence.
-
Il peut mettre en commun cet électron
pour acquérir une configuration électronique de valence en duet.
-
Configuration électronique de l’atome
d’oxygène : 1s22s22p4
-
Il possède 6 électrons sur sa couche
électronique de valence (2s22p4)
-
Il peut mettre en commun 2 électrons
pour acquérir une configuration électronique de valence en octet.
-
Configuration électronique de carbone :
1s22s22p2
-
Il possède 4 électrons sur sa couche
électronique de valence (2s22p2)
-
Il peut mettre en commun 4 électrons
pour acquérir une configuration électronique de valence en octet.

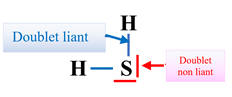
c)- Schéma de Lewis de la
molécule de sulfure de dihydrogène H2S.
-
Configuration électronique de l’atome
d’hydrogène : 1s1
-
Il possède 1 électron sur sa couche
électronique de valence.
-
Il peut mettre en commun cet électron
pour acquérir une configuration électronique de valence en duet.
-
Configuration électronique de l’atome
de soufre (il se situe sous l’oxygène) : …3s23p4
-
Il possède 6 électrons sur sa couche
électronique de valence (3s23p4)
-
Il peut mettre en commun 2 électrons
pour acquérir une configuration électronique de valence en octet.
d)- Schéma de Lewis de la
molécule d’ammoniac NH3,
-
Configuration électronique de l’atome
d’hydrogène : 1s1
-
Il possède 1 électron sur sa couche
électronique de valence.
-
Il peut mettre en commun cet électron
pour acquérir une configuration électronique de valence en duet.
-
Configuration électronique de l’atome
d’azote : …2s22p3
-
Il possède 6 électrons sur sa couche
électronique de valence (2s22p3)
-
Il peut mettre en commun 3 électrons
pour acquérir une configuration électronique de valence en octet.

e)- Schéma de Lewis de la
molécule de méthylamine CH3NH2.
-
Configuration électronique de l’atome
d’hydrogène : 1s1
-
Il possède 1 électron sur sa couche
électronique de valence.
-
Il peut mettre en commun cet électron
pour acquérir une configuration électronique de valence en duet.
-
Configuration électronique de l’atome
d’azote : …2s22p3
-
Il possède 6 électrons sur sa couche
électronique de valence (2s22p3)
-
Il peut mettre en commun 3 électrons
pour acquérir une configuration électronique de valence en octet.
-
Configuration électronique de carbone :
1s22s22p2
-
Il possède 4 électrons sur sa couche
électronique de valence (2s22p2)
-
Il peut mettre en commun 4 électrons
pour acquérir une configuration électronique de valence en octet.

f)- Tableau :
|
Nom |
Formule
brute |
Schéma de
Lewis |
Formule
semi-développée |
|
Molécule
d’eau |
H2O |
|
|
|
Molécule
de méthanol |
CH3OH |
|
|
|
Molécule de
sulfure de
dihydrogène |
H2S |
|
|
|
Molécule
d’ammoniac |
NH3 |
|
|
|
Molécule de
méthylamine |
CH3NH2 |
|
|
►
Cas de molécules complexes :
L'acide nitrique HNO3
QCM réalisé avec Questy pour s'auto-évaluer
Configuration électronique d’un
atome.
Tableau périodique des
éléments.
Entités chimiquement stables.
|
a)- Exercice 5 page 78 : Déterminer un numéro
atomique. b)- Exercice 6 page 78 : Dénombrer les électrons
de valence. c)- Exercice 7 page 78 : reconnaitre les
électrons de valence. d)- Exercice 8 page 78 : dénombre les électrons
de valence à l’aide du tableau périodique. e)- Exercice 11 page 79 : Identifier un élément
chimique à partir de sa position dans le tableau
périodique. f)- Exercice 12 page 79 : Reconnaitre les
éléments d’une même famille. g)- Exercice 16 page 79 : Prévoir la charge d’un
ion. h)- Exercice 17 page 79 : Utiliser la charge
d’un ion. |
|
|