|
De l'atome à l'élément chimique. Cours |
|
|
|
|
|
|
I- Les atomes et les
ions monoatomiques. |
|
III- Du microscopique au
macroscopique. |
|
1)- Formule des composés ioniques :
Les atomes, les ions monoatomiques, l’élément chimique et
du microscopique
au macroscopique |
|
a)- Exercice 2 page 60 : Déterminer un nombre
d’électrons. b)- Exercice N° 07 page 60 : établir l’écriture
conventionnelle d’un noyau. c)- Exercice 8 page 60 : Côté maths d)- Exercice 9 page 60 : Calculer la masse approchée
d’un atome. e)- Exercice 10 page 61 : Calculer un nombre de nucléons f)- Exercice 12 page 61 : g)- Exercice 13 page 61 : h)- Exercice 17 page 61 : i)- Exercice 18 page 61 : |
I- Les atomes et les
ions monoatomiques.
-
Un atome est une entité constituée d’un noyau chargé positivement
-
et d’électrons chargés négativement en mouvement dans le vide
autour du noyau.
-
Une représentation d’un atome :
Cliquer sur l'image pour l'agrandir
a)- Le noyau :
-
Le noyau est constitué de particules appelées nucléons.
-
Les nucléons sont de deux types : les protons et les neutrons.
-
Caractéristiques du proton : il est chargé positivement
-
Masse : mp
= 1,67265
x 10 –
-
Charge : + e = 1,602189
x
10 –
-
Symbole du Coulomb unité de charge électrique : C
-
Caractéristiques du neutron : il est électriquement neutre
-
Masse : mn = 1,67496
x
10 –
-
Charge : nulle
-
Remarque : e
représente la charge élémentaire.
-
Toute charge électrique s’exprime en un nombre entier de charges
élémentaires :
-
Q = n . e
-
La masse du neutron est voisine de celle du proton : mp
≈ mn
b)- Caractéristiques de l’électron : il est chargé
négativement
-
Masse : me
= 9,10953
x
10 –
-
Charge : – e = – 1,602189
x
10 – 19 C
-
Mouvement des électrons autour du noyau :
-
Les électrons d’un atome se déplacent à grande vitesse et à grande
distance autour du noyau.
-
Ils n’ont pas de trajectoire bien définie.
-
C’est pour cela que l’on parle de nuage électronique.
-
On peut délimiter une région de l’espace autour du noyau ou la
probabilité de trouver l’électron est maximale.
-
L’ordre de grandeur du rayon d’un atome est de : 10–10
m
-
L’atome appartient au domaine de l’infiniment petit.
-
Le plus petit des atomes : atome d’hydrogène : rH ≈
52,9 pm.
-
L’un des plus gros : atome de Césium : rCs ≈
265 pm
-
Le rayon des atomes est de l’ordre de 100 pm : 1 pm = 10–12
m
-
L’ordre de grandeur du noyau d’un atome est de 10–15 m
-
Le rayon de l’atome est 100 000 fois plus gros que celui du noyau.
-
Entre les électrons et le noyau, il n’y a que le vide.
-
L’atome a une structure lacunaire.
3)- Symbole du noyau d’un atome.
a)- Grandeurs caractéristiques d’un atome ou du noyau
d’un atome :
-
Le nombre de nucléons est noté A, on l’appelle aussi le
nombre de masse.
-
Le nombre de protons que contient le noyau est noté Z.
-
On l’appelle aussi le numéro atomique ou le nombre de charge.
-
Les deux nombres A et Z suffisent pour caractériser
un noyau.
-
L’atome étant électriquement neutre, le nombre d’électrons d’un
atome est égal au nombre de protons.
-
On dit que l’électroneutralité est vérifiée pour tout atome.
b)- Représentation symbolique :
-
Les atomes sont représentés par des symboles :
-
En général, la première lettre du nom écrite en majuscule.
-
On rajoute parfois une deuxième lettre écrite en minuscule pour
éviter les confusions.
-
On trouve les symboles de tous les atomes dans la classification
périodique que l’on étudiera plus tard.
-
Le symbole du noyau s’obtient à partir du symbole de l’atome
correspondant.
-
Exemple :
-
Symbole de l’atome d’hydrogène : H,
-
Symbole du noyau de l’atome d’hydrogène : ![]()
-
Nombre de protons : 1
-
Nombre de neutrons : 1
-
Nombre d’électrons : 1
-
Formule générale du noyau d’un atome : ![]()
-
Exemple :
![]() symbole du noyau de l’atome de cuivre.
symbole du noyau de l’atome de cuivre.
-
L’atome de cuivre est constitué de 29 protons, 34 neutrons et 29
électrons.
-
Un atome comprend :
-
Z protons,
-
Z électrons, et
-
(A – Z) neutrons.
-
Les deux grandeurs A et Z permettent de caractériser
un noyau ou un atome.
c)- Masse des atomes :
-
Atome le plus léger : atome d’hydrogène : mH =
1,67 x
10 –
-
L’un des plus lourd : atome d’uranium : mU =
3,95 x
10 –
-
Il est environ 240 fois plus lourd.
-
La masse d’un atome est essentiellement concentrée sur son noyau
car la masse des électrons est négligeable devant celle des nucléons :
-
mp ≈
-
La masse d’un atome de nombre de masse A :
-
mAtome
≈ A . mH ≈ A
. mp ≈ A .
mn
-
Un ion monoatomique provient d’un atome ayant gagné ou perdu un ou
plusieurs électrons.
-
Un anion (ion chargé moins)
résulte de la capture d’un ou plusieurs électrons.
-
Un cation (ion chargé
plus) résulte de la perte d’un ou plusieurs électrons.
-
Exemples d’ions monoatomiques :
-
Cℓ
– : L’ion
chlorure provient d’un atome de chlore ayant gagné 1 électron.
-
On peut dans ce cas écrire :
Cℓ + e
–
→ Cℓ
–
-
Na : L’ion sodium provient d’un atome de sodium ayant perdu
1 électron.
-
On peut donc écrire dans ce cas :
Na → Na
+
+ e
–
-
Lors du passage d’un atome à un ion monoatomique, seul le nombre
d’électrons change, le noyau lui n’est pas affecté.
-
Exemples :
|
|
Formule
de l’ion |
Charge
de l’ion |
Symbole
du noyau |
Nombre
de protons |
Nombre
de neutrons |
Nombre
d’électrons |
|
Ion chlorure |
Cℓ
– |
– e |
|
17 |
18 |
18 |
|
Ion cuivre II |
Cu
2+ |
+ 2 e |
|
29 |
34 |
27 |
1)- Exemple de
l’élément cuivre :
-
L’élément cuivre représente ce qui est commun au cuivre métal et à
tous ses composés.
-
Le cuivre métal, l’ion cuivre II, l’oxyde de cuivre II,
l’hydroxyde de cuivre II contiennent l ‘élément cuivre.
|
Entité |
Atome de
Cuivre Cu |
Ion cuivre II Cu
2+ |
Atome de
cuivre Cu |
|
Protons |
29 |
29 |
29 |
|
Neutrons |
34 |
34 |
36 |
|
Électrons |
29 |
27 |
29 |
|
Symbole
de l’élément |
Cu |
Cu |
Cu |
-
Les atomes ou les ions monoatomiques
ayant le même nombre de protons dans leur noyau correspondent au même élément
chimique
-
Le numéro atomique Z
caractérise un élément chimique.
-
Tous les représentants (atomes ou ions) d’un élément ont un noyau
comportant Z protons.
-
Tous les atomes d’un même élément ont le même cortège électronique
et des propriétés chimiques identiques.
3)- Conservation
de l’élément chimique.
-
Au cours des réactions chimiques, les différents éléments se
conservent.
-
Les réactions chimiques n’affectent pas les noyaux.
-
Les éléments présents avant la transformation sont présents après
la réaction.
III- Du microscopique au
macroscopique.
1)- Entité
chimique et espèce chimique :
-
Une entité chimique peut désigner un atome, une molécule ou un ion
(ou un ensemble d’ions) qui constitue la matière à l’échelle microscopique.
-
Une espèce chimique est un ensemble d’un nombre très grand
d’entités chimiques identiques.
-
Exemple :
|
|
Espèces chimiques |
|
|
Fer :
espèce chimique
atomique |
Eau :
espèce chimique moléculaire |
Chlorure de sodium :
espèce chimique ionique |
|
Composée d’atomes de fer de formule
Fe |
Composée de
molécules
d’eau de formule
H2O |
Composée d’une
paire d’ions sodium et d’ions
chlorure de formule
Na+
et Cℓ
– |
2)- Cas des
espèces chimiques ioniques :
-
La matière étant électriquement neutre, les espèces chimiques
ioniques sont constituées d’au moins deux types d’entités :
-
Des anions et des cations.
-
D’autre part, les espèces ioniques étant globalement
électriquement neutre, elles possèdent autant de charge positives que de charges
négatives.
-
Dans le cas du chlorure de sodium, le cristal contient autant
d’ions chlorure (Cℓ –) que d’ions sodium (Na+).
-
Exemple : dans le cas de l’iodure de fer III qui contient les ions
iodure (I–) et des ions fer III (Fe3+).
-
Dans le cristal, il faut 3 ions chlorure pour 1 ion fer III.
-
En conséquence dans le cas d’une espèce chimique ionique, il faut
que les anions et les cations soient dans des proportions telles que le cristal
soit électriquement neutre.
1)- Formule des composés ioniques :
-
Comment écrire la formule d’un solide ionique et le nommer ?
-
Tableau : formules et applications de quelques ions :
|
L’ion Calcium
Ca2+ |
Participe à la
formation des os et des dents |
|
L’ion Magnésium
Mg2+ |
Action
anti-stress |
|
Ion Chlorure
Cℓ – |
Permet de faire
coaguler le lait de soja (pour faire du tofu) |
|
L’ion fer II
Fe2+ ou l’ion fer III
Fe3+ |
Permet de
maintenir les capacités intellectuelles et de lutter contre la
fatigue. Indispensable au bon fonctionnement des défenses
immunitaires. |
|
L’ion cuivre II
Cu2+ |
Anti-oxydant |
|
L’ion zinc II
Zn2+ |
Possède des
propriétés anti-inflammatoires et cicatrisantes ; de ce fait il
est bien connu pour soin action sur l’acné. Contribue à la
synthèse de l’insuline, qui permet de réguler Le taux de sucre
dans le sang. |
|
L’ion iodure
I– |
Intervient dans
la fabrication des hormones thyroïdiennes. |
a)- Règles pour la formulation d’un cristal ionique :
-
Un solide composé d’ions est toujours électriquement neutre.
-
Dans la formule d’un solide ionique, le cation est toujours écrit
en premier.
-
Dans le nom, c’est en revanche l’anion qui est écrit en premier.
-
Dans la formule du cristal ionique, les charges des ions
n’apparaissent pas.
-
La formule d’un cristal ionique est une formule statistique
-
Elle indique la nature et la proportion des ions présents dans le
cristal sans mentionner les charges.
-
Par convention, on choisit les plus petits indices qui assurent
l’électroneutralité du cristal ionique.
b)- Le nigari : Retrouver la formule et le nom de
quelques solides ioniques
![]() Tests
d’identification des ions en solution.
Tests
d’identification des ions en solution. 
-
Le nigari est un solide ionique naturel commercialisé sous forme
de paillettes.
-
Son nom est dérivé du mot japonais signifiant amer.
-
Il sert de coagulant du lait de soja pour préparer le tofu.
-
Ce sel marin cristallisé est une source pure de magnésium.
-
Il est soluble dans l’eau.
-
Pour connaître les ions présents dans le cristal ionique de
nigari, on prépare une solution aqueuse en dissolvant quelques paillettes de
nigari dans de l’eau distillée.
![]() Premier test :
Premier test :
-
On verse 2 mL de solution de nigari dans un tube dans un tube à
essai.
-
On ajoute quelques gouttes de solution aqueuse d’hydroxyde de
sodium (soude)
-
Il se forme un précipité blanc.


-
Ce test est caractéristique des ions magnésium
![]() Deuxième test :
Deuxième test :
-
On verse 2 mL de solution de nigari dans un tube dans un tube à
essai.
-
On ajoute quelques gouttes de nitrate d’argent.
-
Il se forme un précipité blanc qui noircit à la lumière.
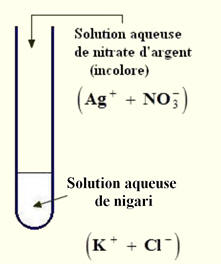

-
Ce test est caractéristique des ions chlorure.
-
Quels sont les ions présents dans la solution aqueuse de nigari.
-
Le premier test met en évidence la présence d’ions magnésium Mg2+
dans la solution de nigari.
-
Le deuxième test met en évidence la présence d’ions chlorure Cℓ
– dans la solution de nigari.
-
Le nigari contient les ions chlorure Cℓ – et les
ions magnésium Mg2+.
-
Déterminer le nom et la formule chimique du nigari.
-
Nom : Chlorure de magnésium et formule du cristal ionique MgCℓ
2
-
En déduire quelles peuvent être ses applications.
-
Les applications possibles :
-
Apport de magnésium, pour participer à la formation des os et des
dents.
-
Faire coaguler le lait de soja pour faire du tofu grâce aux ions
chlorure Cℓ –.
-
Remarque :
-
Le nigari est composé à 95 % de chlorure de magnésium.
-
Les 5 % qui restent sont principalement du sulfate de magnésium.
c)- Nom de quelques solides ioniques :
-
Décrire la méthode permettant de trouver le nom et la formule d’un
solide ionique connaissant les ions qui le constituent.
-
Tableau : Compléter le tableau suivant
|
Ions présents |
Formule
des ions |
Formule du
cristal ionique |
Nom du
cristal ionique |
|
Ion magnésium
et ion chlorure |
Mg2+
Cℓ
– |
MgCℓ
2 |
Chlorure de
magnésium |
|
Ion calcium
et ion chlorure |
Ca2+
Cℓ
– |
CaCℓ
2 |
Chlorure de
calcium |
|
Ion fer III
et l’ion chlorure |
Fe3+
Cℓ
– |
FeCℓ
3 |
Chlorure de
fer III |
|
Ion argent
et ion iodure |
Ag+
I– |
AgI |
Iodure
d’argent |
Les atomes, les ions monoatomiques,
l’élément chimique et
du microscopique
au macroscopique
|
a)- Exercice 2 page 60 : Déterminer un nombre
d’électrons. b)- Exercice N° 07 page 60 : établir l’écriture
conventionnelle d’un noyau. c)- Exercice 8 page 60 : Côté maths d)- Exercice 9 page 60 : Calculer la masse approchée
d’un atome. e)- Exercice 10 page 61 : Calculer un nombre de nucléons f)- Exercice 12 page 61 : g)- Exercice 13 page 61 : h)- Exercice 17 page 61 : i)- Exercice 18 page 61 : |
|
|