|
Les Solutions aqueuses. Cours |
|
|
|
|
|
|
|
|
b)-
Exercice 5 page 42 : Calculer une
concentration en masse. c)-
Exercice 7 page 42 : Déterminer une masse, un
volume et une concentration en masse. d)-
Exercice 8 page 42 : Exploiter des
concentrations en masse. e)-
Exercice 12 page 43 : Calculer une
concentration en masse et une masse volumique. f)-
Exercice 14 page 43 : Choisir le matériel pour
réaliser une dissolution. |
|
|
1)- Solutions, soluté et solvant.
–
Lorsqu’on dissout une espèce chimique dans un
liquide et que l’ensemble forme un mélange homogène, on obtient une solution.
–
L’espèce chimique dissoute est appelée le
soluté.
–
Le liquide dans lequel on dissout l’espèce
chimique est appelé le solvant.
–
Si le solvant utilisé est l’eau, on obtient
une solution aqueuse.
–
Remarque : dans l’eau, on peut dissoudre des
solides, des liquides ou des gaz.
|
Solides |
Liquide |
gaz |
|
Glucose |
Éthanol |
Dioxygène |
|
Chlorure
de sodium |
Acide
éthanoïque |
Dioxyde
de carbone |
2)- Des ions ou des molécules en solution.
–
Les solutés peuvent être des espèces :
–
Ioniques,
–
Moléculaires,
–
Ioniques et moléculaires.
–
Exemples :
–
Soluté ionique :
–
Le soluté est ionique si la solution obtenue
est formée d’ions parmi des molécules d’eau.
–
C’est le cas de la solution aqueuse de sulfate
de cuivre II.
–
La solution contient des ions cuivre II
Cu2+ (aq)
et des ions sulfate SO42– (aq).
–
Lors de la réalisation de la solution avec le
cristal ionique, le soluté réagit avec l’eau.
–
Soluté moléculaire :
–
Le soluté est moléculaire si la solution
obtenue contient des molécules de soluté (soluté moléculaire) et des molécules
d’eau.
– Lors de la réalisation de la solution, le soluté de réagit pas avec l’eau.
–
C’est le cas de la solution de saccharose (C12H22O11)
et de celle du diiode I2.
–
Remarque :
–
Il se peut que le soluté moléculaire réagisse
partiellement avec l’eau pour donner des ions.
–
La solution aqueuse contient alors : des ions
et des molécules de soluté n’ayant pas réagi.
II-
La concentration en masse.
–
La concentration en masse, ou concentration
massique ou titre massique.
– La concentration en masse, ou titre massique, t d’une solution en espèce chimique dissoute
est le
quotient de la masse msoluté
de soluté par le volume Vsolution
de la solution.
–
Relation :
|
|
t : concentration en masse en
soluté en g / L
msoluté
:
masse de soluté en g.
Vsolution
:
volume de la solution en L. |
|
Autre écriture de la relation : Cas
d’une espèce chimique A |
|
|
|
t (A) : concentration en
masse en soluté apporté en g / L
m (A) : masse de soluté
apporté en g.
V
= Vsolution
:
volume de la solution aqueuse obtenue en L. |
–
Étiquette d’une eau minérale :
|
Eau de source de montagne |
|
|
Analyse moyenne |
|
|
Calcium (Ca2+) |
64,5 mg / L |
|
Magnésium (Mg2+) |
3,5 mg / L |
|
Sodium (Na+
) |
12,0 mg / L |
|
Potassium (K+
) |
0,5 mg / L |
|
Fluorure (F
– ) |
<
0,1 mg / L |
|
Hydrogénocarbonate (HCO3–
) |
195,0 mg / L |
|
Chlorure (Cl–
) |
20,0 mg / L |
|
Sulfate (SO42
– ) |
6,0 mg / L |
|
Nitrate (NO3–
) |
2,5 mg / L |
|
Nitrite (NO2–
) |
<
0,05 mg / L |
|
Résidu sec à 180 ° C : 223,0 mg / L |
|
–
L’étiquette donne la concentration en masse
des ions présents dans l’eau minérale.
– Dans une fiole jaugée de 100 mL, on introduit 2,5 g de glucose,
puis on complète avec de l’eau distillée jusqu’au trait de jauge.
On mélange afin d’homogénéiser la solution.
–
Calculer la valeur
de la concentration en masse t
de la solution de glucose.
–
Dans le cas présent, le soluté est le
glucose :
–
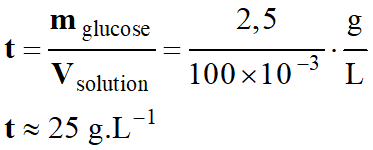
–
Il ne faut pas
confondre la masse volumique ρsolution
avec la concentration en masse tsoluté
d’un soluté dans une solution.
–
Ces deux grandeurs s’expriment dans la même
unité.
–
Mais ces deux grandeurs sont différentes.
|
Concentration en masse |
Masse volumique |
|
Grandeur relative à un
soluté de la solution |
Grandeur relative à
la solution |
III-
Préparation des solutions.
–
La balance qui sert à peser les espèces
chimiques solides et liquides.
–
Les capsules et verres de montre qui peuvent
contenir des solides (on les utilise lors des pesées)
–
Les récipients comme les béchers et
erlenmeyers qui peuvent contenir des espèces chimiques liquides ou des solutions
aqueuses.
– La verrerie qui permet la mesure du volume d’une solution :
l’éprouvette graduée, la pipette jaugée, la pipette graduée, la
fiole jaugée et la burette graduée.
–
Une pipette simple pour ajuster les volumes et
une pissette d’eau distillée.
|
Balance |
|
|
|
|
|
|
Burette
|
|
|
Pipette graduée de 10 mL, munie de sa propipette |
Pipette graduée de 2 mL ou 5 mL, munie de sa propipette |
||
a)-
Introduction :
–
La dissolution
est l’obtention d’une solution
par mélange d’un solvant et d’une espèce chimique.
b)-
Application :
–
On souhaite préparer un volume
V = 100 mL d’une
solution aqueuse de glucose de concentration en masse
t = 18,0 g / L à
partir de glucose solide.
–
Indiquer le matériel utilisé et donner le mode
opératoire.
–
Déterminer la masse de glucose nécessaire à la
préparation de la solution.
–
Matériel utilisé :
–
Une balance pour peser le glucose, un verre de
montre, un entonnoir, une fiole jaugée de 100 mL et de l’eau distillée.
–
Mode opératoire :
–
On pèse la masse
m de soluté au
moyen d’une balance.
–
On place le soluté dans un récipient et on
utilise la fonction tare de la balance pour lire directement la masse du contenu
du récipient.
–
On introduit le
solide dans une fiole jaugée de volume V
= 100 mL en utilisant un entonnoir.
–
On rince le récipient utilisé et l’entonnoir
avec une pissette d’eau distillée.
–
L’eau de rinçage doit couler dans la fiole
jaugée.
–
On remplit la fiole jaugée environ aux trois
quarts avec de l’eau distillée et on agite pour accélérer la dissolution et
homogénéiser la solution.
-
On complète avec de l’eau distillée
jusqu’au trait de jauge.
–
On ajuste le niveau avec une pipette simple.
–
On bouche et on agite pour homogénéiser.
–
Masse de glucose nécessaire :
–
m =
t . V
(2)
–
Application numérique :
–
m ≈ 18,0
x 100
x 10–3
–
m ≈ 1,80 g
c)-
Schématisation des différentes étapes :
| Protocole | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a)-
Principe :
–
La dilution d’une solution aqueuse est l’ajout
d’eau à cette solution.
–
La solution aqueuse obtenue (solution fille)
est moins concentrée que la solution initiale (solution mère).
b)-
Schématisation des différentes étapes :
|
Verser suffisamment de solution Mère dans un bécher |
Deuxième étape : On prélève le volume nécessaire de solution Mère à l’aide d’une pipette jaugée munie de sa propipette |
Troisième étape : On verse le volume nécessaire de solution dans la fiole jaugée de volume approprié.. |
|
On ne pipette jamais directement dans le flacon qui contient
la solution
Mère |
|
|
|
Quatrième étape : On ajoute de l’eau distillée et on agite mélanger et homogénéiser |
Cinquième étape : On complète avec une pissette d’eau distillée jusqu’au trait de jauge. |
Sixième étape : on agite pour homogénéiser. La solution est prête. |
|
|
|
|
c)-
Remarques importantes :
–
Au cours d’une
dilution, la masse de soluté mm
prélevé dans la solution mère est égale à la masse de soluté
mf
présent dans la solution fille.
–
En conséquence :
–
mm
= mf
–
tm
. Vm
= tf
. Vf
–
Facteur de dilution
F :
–
Le facteur de
dilution est le nombre qui caractérise la dilution
effectuée.
–
Il est défini par la relation suivante :
![]()
–
Comme
tm
> tf,
le facteur de dilution F
> 1
d)-
Application :
–
On désire diluer 20 fois une solution mère de
diiode pour préparer un volume Vf
= 200 mL d’une solution fille de diiode.
–
Déterminer le volume de solution mère
nécessaire à la préparation de la solution.
–
Indiquer le matériel utilisé et donner le mode
opératoire.
–
Réponse :
–
On connait le
facteur de dilution F
= 20.
–
Connaissant le volume de la solution fille à
préparer, on peut en déduire le volume de la solution mère à prélever.
–
Relation :
–
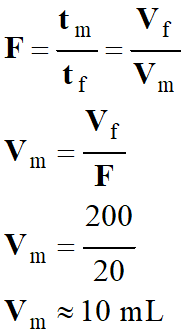
–
Matériel :
–
Récipient : bécher ou erlenmeyer.
–
Matériel permettant la mesure précise de
volumes :
–
Une pipette jaugée de 10 mL muni de sa
propipette.
–
Une fiole jaugée de 200 mL
–
Pipette simple pour ajuster le volume.
–
Solutions : solution mère et pissette d’eau
distillée.
![]() Mode opératoire :
Mode opératoire :
–
On verse un peu de solution mère dans un
bécher (on ne pipette jamais dans le récipient qui contient la solution mère).
–
On prélève le volume
Vm
= 10 mL à l’aide d’une pipette jaugée muni de sa propipette.
–
On verse le volume
Vm
= 10 mL dans une fiole jaugée de 200 mL.
–
On remplit la fiole jaugée environ aux trois
quarts avec de l’eau distillée.
–
On mélange.
– On complète avec de l’eau distillée jusqu’au trait de jauge.
- On ajuste le niveau avec une pipette simple.
-
On bouche et on agite pour
homogénéiser.
1)- Dosage à l’aide d’une
gamme d’étalonnage.
|
Exercices : b)-
Exercice 5 page 42 : Calculer une
concentration en masse. c)-
Exercice 7 page 42 : Déterminer une masse, un
volume et une concentration en masse. d)-
Exercice 8 page 42 : Exploiter des
concentrations en masse. e)-
Exercice 12 page 43 : Calculer une
concentration en masse et une masse volumique. f)-
Exercice 14 page 43 : Choisir le matériel pour
réaliser une dissolution. |
|
|