|
Chimie. Correction |
|
|
|
|
Exercice II. FABRICATION PUIS TITRAGE DE L'ASPIRINE (6 points) |
|
On considère une réaction d'estérification
entre un acide carboxylique de formule
R―COOH
et
un alcool
R'―CH2OH A l'instant t = 0, on mélange 0,20 mol d'acide et 0,20 mol d'alcool.
On effectue la réaction
d'estérification en présence d'acide sulfurique à l'aide d'un chauffage à
reflux .
1.1. Écrire l'équation chimique correspondant à l'estérification. Équation chimique :
R―COOH
1.2
Remplir
la ligne concernant l'état intermédiaire dans le tableau d'avancement représenté
en annexe 3. |
|
Équation |
R―COOH |
+ R―CH2OH |
= |
Ester |
+ H2O |
|
|
|
Avancement |
n
(acide)
|
n
(alcool) |
|
n
(ester) |
H2O |
|
État initial
(mol) |
x
= 0 |
0,20 |
0,20 |
|
0 |
0 |
|
État
Intermédiaire
(mol) |
x |
0,20 – x |
0,20 – x |
|
|
|
|
État
d’équilibre
(mol) |
x
= xeq |
|
|
|
|
|
|
1.3. Quel serait l'avancement xmax en fin de réaction si celle-ci était totale ?
Avancement
maximal si la réaction était totale : - xmax = 0,20 |
|
Équation |
R―COOH |
+ R―CH2OH |
= |
Ester |
+ H2O |
|
|
|
Avancement |
n
(acide)
|
n
(alcool) |
|
n
(ester) |
H2O |
|
État initial
(mol) |
x
= 0 |
0,20 |
0,20 |
|
0 |
0 |
|
État
Intermédiaire
(mol) |
x |
0,20 – x |
0,20 – x |
|
|
|
|
État
(mol) |
x
= xmax |
|
|
|
|
|
| 0,20 | 0 | 0 | 0,20 | 0,20 | ||
|
1.4. L'expérience donne un avancement xeq = 0,13 mol d'ester à l'équilibre. Compléter le tableau. Calculer le rendement η de cette réaction.
Rendre avec la copie la feuille comportant le tableau
(Annexe 3). |
|
Équation |
R―COOH |
+ R―CH2OH |
= |
Ester |
+ H2O |
|
|
|
Avancement |
n
(acide)
|
n
(alcool) |
|
n
(ester) |
H2O |
|
État initial
(mol) |
x
= 0 |
0,20 |
0,20 |
|
0 |
0 |
|
État
Intermédiaire
(mol) |
x |
0,20 – x |
0,20 – x |
|
|
|
|
État
(mol) |
x
= xeq |
|
|
|
|
|
| 0,13 | 0,07 | 0,07 | 0,13 | 0,13 | ||
|
Rendement η de cette réaction :
|
|
On prépare l'aspirine à partir de l'acide salicylique qui porte un groupement – OH (fixé sur le cycle benzénique)
et peut, comme un alcool,
subir une estérification.
Pour
avoir un meilleur rendement, au lieu d'un acide carboxylique, on utilise
un
anhydride d'acide. Dans un erlenmeyer, on introduit 5,00 g d'acide salicylique. 7,0 mL d'anhydride et 5 gouttes d'acide sulfurique.
Ce mélange est chauffé à reflux à 60 ° C
pendant 20 minutes avec agitation. On retire l'erlenmeyer du bain-marie et, avec précaution, on ajoute environ 50 mL d'eau distillée froide par le haut du réfrigérant ; On place l'erlenmeyer dans de l'eau glacée.
L'aspirine
formée précipite : elle est ensuite filtrée sur büchner. Pour purifier cette aspirine, on effectue une recristallisation dans un mélange eau-alcool. Pour cela, on dissout les cristaux dans 10 mL d'éthanol à 95 ° en chauffant au bain-marie. Après dissolution complète, on ajoute 30 mL d'eau chaude. On laisse ensuite refroidir à température ambiante puis dans la glace : l'aspirine précipite.
On filtre et on sèche à l'étuve les
cristaux obtenus.
Le
produit sec est pesé : sa masse est de 4,20 g. L'anhydride d'acide utilisé est noté A.
L'équation de la réaction de synthèse de l'aspirine est de la forme
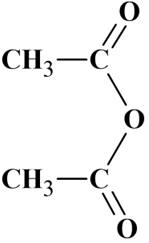 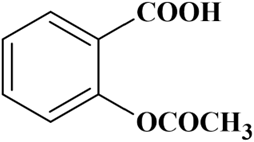 + CH3COOH
+ CH3COOH2.1. Préciser la formule semi-développée de l'anhydride A utilisé dans l'équation ci-dessus et donner son nom.
Formule
semi-développée de l’anhydride A : c’est l’anhydride éthanoïque
2.2. Dessiner et légender le montage de chauffage à reflux .
Montage :
le chauffage à reflux :
2.3. Déterminer le réactif limitant (consulter les données).
Réactif
limitant :
Quantité
de matière d’acide salicylique :
Quantité
de matière d’anhydride éthanoïque :
|
|
Équation |
|
|
= |
|
+ CH3COOH |
|
|
État |
Avanc.
(mol) |
nsal
|
nA |
|
nasp |
netha |
|
État
initial |
x
= 0 |
nsal
≈ 3,6 × 10 –2 |
nA
≈ 7,4
×
10 –2 |
|
0 |
0 |
|
État inter. |
x
|
0,0362 –
x |
0,074 –
x |
|
x |
x |
|
Si
réaction
totale
|
xmax |
0,0362 –
xmax ≥
0 |
0,074 –
xmax ≥
0 |
|
xmax =
0, 0362 |
xmax =
0,0362 |
|
En conséquence, xmax = 0,0362 mol et l’acide salicylique est en défaut
et l’anhydride éthanoïque
A est en excès. 2.4. Calculer la masse d'aspirine obtenue si le rendement était de 100 %.
Calculer le rendement effectif de cette réaction.
Masse
d’aspirine obtenue si le rendement était de 100 % : - masp = nasp . M(asp) - masp = xmax . M(asp)- masp ≈ 0,0362 × 180 - masp ≈ 6,52 g
Données
|
|||||||||||||||||||||||||||||||||||
|
On
prélève 1,00 g de l'aspirine fabriqué précédemment et on en effectue un
titrage indirect :
On
réalise l'hydrolyse de l'ester par un excès de soude puis les ions
HO–
restants sont titrés à l'aide d'une solution d'acide
chlorhydrique. Dans un erlenmeyer, on place 1,00 g d'aspirine, on ajoute un volume V0 = 20,0 mL d'une solution d'hydroxyde de sodium de concentration C0 = 1,00 mol / L et environ 20 mL d'eau. L'ensemble est chauffé sous reflux pendant 10 minutes.
La solution obtenue est appelée
S1.
L'équation
de la réaction correspondante est : |
|
Après refroidissement, le contenu de l'erlenmeyer est versé dans une fiole jaugée de 250 mL. De l'eau distillée est versée jusqu'au trait de jauge : soit S2 la solution obtenue. A l'aide d'une pipette jaugée, on prélève 10,0 mL de solution S2 que l'on verse dans un bécher.On ajoute quelques gouttes de phénolphtaléïne . On effectue le titrage des ions HO – en excès de S2 par une solution d'acide chlorhydrique de concentration C1 = 5,00 × 10 – 2 mol / L .Le volume versé à l'équivalence est V1 = 7,4 mL. 3.1. Calculer la quantité de matière n0 d'ions HO – ajoutés à l'aspirine pour fabriquer S1.
Quantité
de matière
n0
d'ions HO
– ajoutés
à l'aspirine
n0
= C0. V0
≈ 1,00
× 20,0
× 10 – 3 n0
≈ 2,00
× 10 – 2
mol
3.2. Écrire l'équation de la réaction de titrage.
Équation
de la réaction de titrage :
3.3. Calculer la quantité de matière n2 d'ions HO – titrés par l'acide chlorhydrique.
En déduire la quantité de matière
n1 d'ions
HO
– en
excès dans la solution S1.
Quantité
de matière
n2
d'ions HO
– titrés
par l'acide chlorhydrique de
S2
. À L’équivalence, la quantité de matière d’ions oxonium ajoutée est égale
à la quantité de matière d’ions hydroxyde restante : - n2 = C1. V1
-
n2
≈
5,00
× 10 –2 ×
7,4
× 10 – 3 - n2 ≈ 3,7 × 10 – 4 mol Quantité de matière n2 d'ions HO – en excès dans la solution S1 : O n a dosé 10 mL de S2
Quantité
de matière d’ions
HO
–
en excès dans 250 mL de
solution
S2 :
-
-
3.4. Calculer la quantité de matière nasp puis la masse d'aspirine initialement présentes dans la solution S1 .
Quantité
de matière d’ions hydroxyde ayant réagi avec l’aspirine :
-
nr ≈
2,00
×
10 – 2
− 9,25
× 10 – 3 mol
Quantité
de matière d’aspirine initialement présente dans la solution
S1 : D’après le bilan de quantité de matière de l’équation de la réaction :
3.5. Comparer 1a valeur trouvée à la valeur attendue. Justifier l'écart
observé. Masse d’aspirine initialement présente : masp = nasp.M (asp)
masp
≈ 5,4 × 10 – 3 × 180
Alors
que la masse d’aspirine prélevée est de 1 g.
Écart
: Des erreurs sont commises lors de la prise des 10 mL avec la pipette jaugée, lors de la lecture du volume versé à la burette de Mohr, lors de la pesée de l’aspirine prélevée.
On ne peut attendre plus de précision d’un dosage
colorimétrique. |
|
|
|
|