|
TP Chimie. N° 11 |
Préparation de solutions. Enoncé. |
|
|
Programme 2018 : Physique et chimie |
|
|
|
I - Dissolution d'une espèce chimique moléculaire solide. |
|
Matériel : |
- deux balances électroniques, béchers, - coupelle ou verre de montre,
- Fiole jaugée de 250 mL ou 100 mL, - pipette jaugée de 10 mL et 20 mL, - Entonnoir,
pipette simple, pissette d’eau distillée. |
|
- solution de sulfate de cuivre II de concentration C = 1,0 mol / L, eau distillée. |
I- Dissolution d’une espèce
chimique moléculaire solide.![]()
1)-
Expérience.
![]() Peser ½
de
sucre en utilisant une balance électronique et une coupelle ou un verre de
montre
Peser ½
de
sucre en utilisant une balance électronique et une coupelle ou un verre de
montre
- introduire le solide dans une fiole jaugée de volume V = 250 mL en utilisant un entonnoir.
- rincer le récipient utilisé et l’entonnoir avec une pissette d’eau distillée.
- L’eau de rinçage doit couler dans la fiole jaugée.
- remplir la fiole jaugée environ aux trois quarts avec de l’eau distillée.
- Agiter pour accélérer la dissolution et homogénéiser la solution.
- Compléter avec de l’eau distillée jusqu’au trait de jauge.
- On ajuste le niveau avec une pipette simple.
- Boucher et agiter
pour homogénéiser. La solution est prête.
![]() Schématiser les opérations nécessaires à la préparation de la
solution sucrée en indiquant toute la verrerie utilisée.
Schématiser les opérations nécessaires à la préparation de la
solution sucrée en indiquant toute la verrerie utilisée.
2)-
Compte-rendu.
a)- Étude préliminaire.
- On considère que le sucre est du saccharose de formule brute :
C12H22O11.
- Indiquer la nature du soluté.
- Indiquer le nom du solvant utilisé.
- Quelles sont les caractéristiques de la solution aqueuse obtenue ?
- Indiquer la valeur de la masse du morceau de sucre :
m =
- Déterminer la valeur de la masse molaire du saccharose :
M =
- Déterminer la valeur de la quantité de matière
n de saccharose que l’on a introduit dans la fiole
jaugée.
b)- Concentration molaire.
- La concentration molaire d’une espèce chimique en solution est la quantité de matière de soluté présente dans un litre de solution.
- Relation :
|
► n : la quantité de matière de soluté en mol. ► V : le volume de la solution en L ► C : la concentration molaire en soluté de la solution aqueuse en mol / L |
-
On parle aussi de concentration
molaire volumique.
- Calculer la concentration molaire de la solution sucrée.
- Remarque : pour une espèce moléculaire, on peut utiliser la lettre C pour représenter une concentration mais on peut utiliser aussi la notation suivante :
- [C12H22O11 ].
II-
Dilution d’une solution de
concentration connue.![]()
1)-
Expérience à réaliser.
|
- Situation problème : À partir d’une solution mère S0 de sulfate de cuivre II de concentration C0 = 1,0 mol / L, on veut préparer un volume V = 100 mL d’une solution fille de concentration C = 0,10 mol / L. - Comment procéder ? Quel matériel utiliser ? |
2)-
Analyse de la situation.
- On doit effectuer une dilution car la concentration molaire du soluté
diminue.
- Lors d’une dilution, la concentration molaire du soluté diminue, mais sa quantité de matière ne change pas.
- On dit qu’au cours d’une dilution, la quantité de matière de soluté se conserve.
- La solution de départ est appelée la solution mère et la solution diluée est appelée la solution fille.
|
S 1 |
{ |
C 1 = |
Dilution |
S 2 |
{ |
C 2 = |
|
V 1 = ? |
→ |
V 2 = |
||||
|
n 1 = C 1 . V 1 |
|
n 2 = C 2 . V 2 |
||||
|
Solution mère |
|
Solution fille |
||||
|
- si A représente l’espèce présente dans la solution. - La quantité de matière nA de cette espèce est la même dans la solution mère et dans la solution fille. - Il y a conservation de la quantité de matière de soluté : - la quantité de matière de soluté présente dans la solution mère : n1 = C1 . V1 (1) - la quantité de matière de soluté présente dans la solution fille : n2 = C2 . V2 (2) - Conséquence : C1 . V1 = C2 . V2 avec obligatoirement V1 < V2. |
3)- Calcul du volume de solution mère à prélever.
- 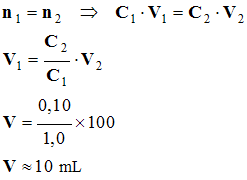
4)-
Manipulation.
![]() Préparation de la solution fille.
Préparation de la solution fille.
|
- On verse suffisamment de solution mère dans un bécher On ne pipette jamais dans le récipient qui contient la solution mère - On prélève le volume V = 10 mL à l’aide d’une pipette jaugée muni de sa propipette. - On verse le volume V = 10 mL dans une fiole jaugée de 100 mL. - On remplit la fiole jaugée environ aux trois quarts avec de l’eau. - On complète avec de l’eau distillée jusqu’au trait de jauge. - On ajuste le niveau avec une pipette simple. - On bouche et on agite pour homogénéiser.
La solution est prête. |
5)-
Compte-rendu.
![]() Schématiser les opérations nécessaires à la préparation de la
solution fille en indiquant toute la verrerie utilisée.
Schématiser les opérations nécessaires à la préparation de la
solution fille en indiquant toute la verrerie utilisée.
![]() Pourquoi le trait de jauge est-il dans la partie étroite de la fiole jaugée ?
Pourquoi le trait de jauge est-il dans la partie étroite de la fiole jaugée ?
![]() Comparer les teintes des solutions mère et fille. Conclusion.
Comparer les teintes des solutions mère et fille. Conclusion.
III-
Matériel
et verrerie utilisés en chimie.![]()
|
|
|
|
|
|
|
|
|
Burette Graduée |