|
TP Chimie. N° 05 |
Notion d'élément chimique. Correction. |
|
|
Programme 2010 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
|
|
Matériel et
Produits
: |
2 béchers, 1 agitateur en verre, 1 entonnoir avec un porte entonnoir, du papier filtre, 1 un râtelier de tube à essais, tube à dégagement, verre à pied, pince en bois, bec bunsen. Acide nitrique concentré, tournure de cuivre (prof). Fer en poudre, solution de soude, oxyde de cuivre II, mélange spécial :
oxyde de cuivre II et carbone, eau de chaux, solution de sulfate de
cuivre II |
I-
Réaction entre le cuivre métal et l’acide nitrique concentré (réaction
A).![]()
![]() L’expérience est réalisée par le professeur :
L’expérience est réalisée par le professeur :
![]() Faire un schéma légendé du dispositif expérimental.
Faire un schéma légendé du dispositif expérimental.
|
Montage 1 :
Montage 2 :
|
![]() Indiquer les observations.
Indiquer les observations.
|
- On observe : - La disparition du morceau de cuivre au cours de l’expérience, - La formation d’un gaz incolore qui donne des vapeurs rousses au contact de l’air. - Lorsque la réaction est finie, on remarque que le cuivre métal (solide rouge) a totalement disparu. |
![]() Quelles sont les caractéristiques de la solution obtenue ?
Quelles sont les caractéristiques de la solution obtenue ?
|
- On obtient une solution
homogène de couleur bleue. -
|
ʘ Cette solution est appelée : solution S et elle est distribuée aux élèves pour une étude complémentaire.
II-
Réaction avec la solution obtenue (solution S).![]()
1)- Caractérisation d’un ion présent dans la solution S obtenue.
a)- Expérience A :
![]() Prendre un tube à essais,
Prendre un tube à essais,
- Verser environ 2 mL de solution S,
- Ajouter quelques gouttes de soude (solution aqueuse d’hydroxyde de sodium),
b)- Compte-rendu :
![]() Faire les schémas et indiquer les observations.
Faire les schémas et indiquer les observations.
|
On
observe la formation d’un précipité bleu d’hydroxyde de
cuivre II.
|
ʘ
- Quel ion a-t-on caractérisé dans la solution S ?
|
- La
réaction précédente permet de mettre en évidence l’ion cuivre II - Écriture symbolique de l’ion cuivre II : Cu 2+ |
- Écrire l’équation bilan de la réaction de précipitation.
|
Cu2+ (aq)
+ 2 HO – (aq)
→
Cu (OH)2
(s)
|
2)- Chauffage de l’hydroxyde de cuivre II.
a)- Expérience B.
![]() Récupérer le précipité d’hydroxyde de cuivre II et le
placer dans un tube à essais.
Récupérer le précipité d’hydroxyde de cuivre II et le
placer dans un tube à essais.
- Chauffer, à l’aide du bec bunsen, le tube à essais contenant le précipité d’hydroxyde de cuivre II jusqu’à disparition de la teinte bleue.
ʘ
- Le solide noir obtenu est constitué d’ions cuivre II, Cu2+ et d’ions oxygène O2–.
b)- Compte-rendu :
![]() Faire les schémas et indiquer les observations.
Faire les schémas et indiquer les observations.
- Donner la formule et le nom du solide noir.
|
- Formule :
CuO - Nom :
Oxyde de cuivre II. |
- Écrire l’équation bilan de la réaction de déshydratation de l’hydroxyde de cuivre II.
|
Cu(OH)2
(s) |
3)- Réaction entre l’oxyde de cuivre II et le carbone.
a)- Expérience C.
![]() Dans un tube à essais, verser le mélange d’oxyde de cuivre
II et de carbone (solide finement divisé : poudre noire).
Dans un tube à essais, verser le mélange d’oxyde de cuivre
II et de carbone (solide finement divisé : poudre noire).
- Disposer un tube à dégagement à l’extrémité du tube à essais.
- Chauffer le tube à essais en le tenant avec une pince en bois et plonger le tube à dégagement dans l’eau de chaux lorsque la réaction démarre.
- Maintenir le chauffage quelques instants.
b)- Compte-rendu :
![]() Faire les schémas et indiquer les observations.
Faire les schémas et indiquer les observations.
- Donner la nature, le nom et la formule du gaz qui se dégage.
- Donner le nom du solide rougeâtre obtenu.
|
- Le
gaz qui trouble l’eau de chaux est du dioxyde de carbone :
CO2 - Le
solide rougeâtre obtenu
est du cuivre solide :
Cu
|
- Écrire l’équation bilan de la réaction entre l’oxyde de cuivre II et le carbone.
|
2 CuO
(s) |
4)- Acton du fer sur la solution S (pour ceux qui ont le temps).
a)- Expérience D.
![]() Dans un bécher, verser quelques mL de la
solution
S.
Dans un bécher, verser quelques mL de la
solution
S.
- Ajouter du fer en poudre.
- Agiter le mélange avec l’agitateur en verre jusqu’à décoloration de la solution.
- Filtrer le contenu du bécher (ou tube à essais).
![]() Test complémentaire :
(à finir)
Test complémentaire :
(à finir)
- Verser 2 mL de filtrat dans un tube à essais et ajouter quelques gouttes de soude.
b)- Compte-rendu.
![]() Faire des schémas et indiquer les observations (en particulier
examiner le solide obtenu par filtration).
Faire des schémas et indiquer les observations (en particulier
examiner le solide obtenu par filtration).
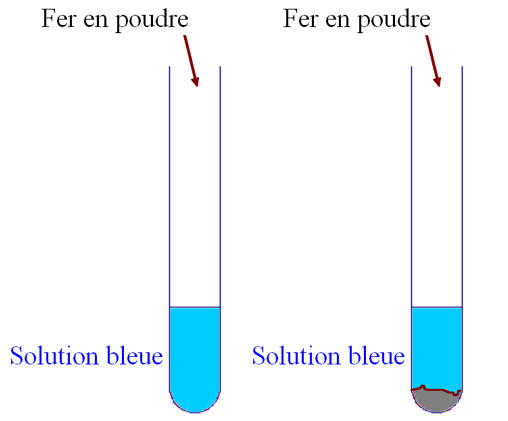
-
On verse le fer en poudre dans la
solution S
contenue dans un tube à essais.
-
À l’aide d’un
agitateur en verre, on agite le mélange réactionnel.
-
On remarque que la
solution se décolore et que la poudre prend une teinte rougeâtre.

-
On filtre le mélange
réactionnel obtenu,
-
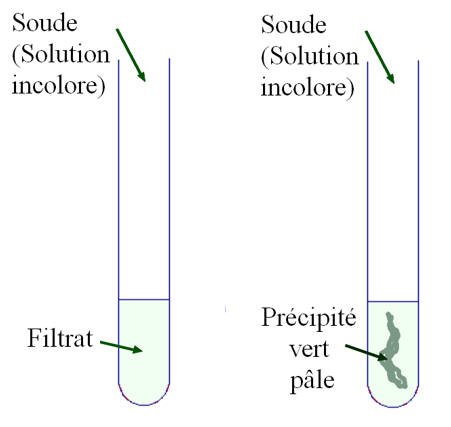
On verse la solution
obtenue dans un tube à essais et on ajoute quelques gouttes de soude.

- Que peut-on déduire du test complémentaire ?
- La solution de filtrat ne contient plus ions cuivre II.
- On obtient pas de précipité bleu d'hydroxyde de cuivre II.
►Il se forme un précipité vert pâle d’hydroxyde de fer II Fe(OH)2 (s).
- Ce test permet de caractériser l’ion fer II.
- Remarque : Il s’oxyde rapidement à l’air et change rapidement de couleur. Il passe du vert, vert-noir, au noir puis au rouille.
- Écrire l’équation bilan de la réaction de précipitation sachant que le précipité obtenu est de l’hydroxyde de fer II.
|
Fe2+
(aq) + 2 HO – (aq) →
Fe(OH)2 (s) |
- Quel ion a-t-on caractérisé dans la solution de filtrat ?
- On a mis en évidence la présence d'ions fer II dans le filtrat
![]() À partir de l’ensemble des réactions que l’on a réalisé,
faire un cycle,
À partir de l’ensemble des réactions que l’on a réalisé,
faire un cycle,
- en indiquant sous quelle forme se trouve l’élément cuivre après chaque réaction.
- L’élément cuivre est ce qui est commun au cuivre métal et à tous ses composés.
|
L’élément cuivre est ce qui est commun au cuivre métal et à tous ses composés comme :
l’ion cuivre II, l’hydroxyde de cuivre II, l’oxyde de
cuivre II,… |