|
Phys. N° 04 |
Les Messages de la Lumière. Cours. |
|
|
Programme 2010 : La lunière des étoiles Programme 2010 : Physique et Chimie Programme 2020 : Physique et Chimie |
|
|
|
I- Les spectres d’émission.
(en relation avec le
TP physique N° 05). |
|
II- Les spectres d’absorption.
(en relation avec le
TP physique
N° 06) |
|
Exercices 2005-2006 |
|
Physique et Chimie seconde Collection DURANDEAU HaCHETTE |
|
Exercice 03 page 68 |
|
Exercice 07 page 69 |
|
Exercice 10 page 69 |
|
Exercice 13 page 70 |
|
Exercice 15 page 71 |
|
Exercice 19 page 71 |
|
Physique et Chimie seconde |
|
Collection Microméga Hatier Ancienne édition |
|
1)- Exercice 3 page 222. |
|
2)- Exercice 4 page 222. |
|
3)- Exercice 5 page 222. |
|
4)- Exercice 12 page 222. |
|
5)- Exercice 14 page 222. |
|
6)- Exercice 16 page 223. |
Pour aller plus loin :
|
Logiciel pour l'étude de la lumière et des spectres |
Gratuit |
|
Mots clés : La lumière blanche ; le prisme ; décomposition de la lumière blanche ; spectres d'émission ; spectres d'absorption ; lumière des étoiles ; température et couleurs ; les radiations lumineuses ; ... |
I- Les spectres d’émission. (En relation avec le TP physique N° 05).
- Un spectre d’émission est un spectre produit par la lumière directement émise par une source.
- Un spectre lumineux est la figure obtenue par décomposition d’une lumière complexe en ses radiations lumineuses.
2)- Les spectres continus d’origine thermique.
- Exemples :
- La lampe à incandescence dont on augmente la valeur de la tension. La combustion d’un morceau de charbon.
- Tout corps chauffé à une température suffisante émet de la lumière.
- Le spectre de la lumière émise par un corps chauffé est un spectre d’origine thermique.
- Le corps peut être un solide, un liquide que l’on chauffe ou un gaz fortement comprimé.
- Résultats importants :
- Les spectres d’origine thermique sont des spectres continus.
- Le spectre évolue avec la température.
- Lorsque la température augmente, le spectre devient de plus en plus lumineux et s’enrichit de couleurs vertes, bleues puis violettes.
- Il s’étale vers les violets et ultraviolets. Il s‘étale vers les courtes longueurs d’onde.
- Exemple :
- La lampe à vapeur de mercure.
Cliquer sur l'image pour l'agrandir
- La lampe contient des atomes de mercure sous faible pression.
- On excite les atomes de mercure grâce à des décharges électriques.
- Observations :
- Le spectre obtenu est discontinu.
- Il est constitué d’un nombre limité de radiations.
|
Conclusion : - Un gaz, à faible pression et à température élevée, émet une lumière constituée d’un nombre limité de radiations. - On obtient un spectre de raies. - Le spectre obtenu est caractéristique des atomes du gaz qui émet les radiations. - Un spectre de raies constitue la signature d’un élément chimique et révèle sa présence. - Il permet d’identifier une entité chimique (atome ou ion). |
![]() Expérience :
Expérience :
- Dans la flamme non éclairante d’un bec Mecker, on porte un fil de platine ayant été trempé dans une solution de chlorure de sodium.
- La solution contient les ions sodium et les ions chlorure.
- Observations :
- La flamme dans laquelle, on a placé le fil de platine ayant été trempé dans une solution de chlorure de sodium, est jaune.
- Elle met en évidence la présence de l’élément sodium.
|
Conclusion : - Le spectre de la lumière émise par la flamme est semblable à celui de la lumière émise par la lampe à vapeur de sodium. - Les ions et les atomes émettent de la lumière dont le spectre est appelé : spectre de flamme. - Il est constitué de raies. - Les radiations émises sont caractéristiques de la nature chimique des atomes ou des ions présents dans la flamme. |
- Exploitation :
- En analyse chimique, on utilise les couleurs de flamme pour rechercher certains ions dans une solution.
- Les radiations émises sont caractéristiques de la nature chimique des atomes ou des ions présents dans la flamme.
- Quelques couleurs de flamme :
|
Couleurs émises par quelques composés lors de la combustion |
|||
|
Couleur |
Éléments |
Composés |
Formule |
|
Violet
|
Potassium |
Nitrate de potassium |
KNO3 |
|
Bleu |
Cuivre |
Chlorure cuivreux |
CuCl |
|
Vert |
Baryum |
Nitrate de baryum |
Ba(NO3)2 |
|
Jaune |
Sodium |
Oxalate de sodium |
Na2C2O4 |
|
Orangé |
Calcium |
Nitrate de calcium |
Ca(NO3)2
|
|
Rouge |
Strontium |
Nitrate de strontium |
Sr(NO3)2 |
|
Baryum |
Calcium |
Cuivre |
Potassium |
Lithium |
Sodium |
Strontium |
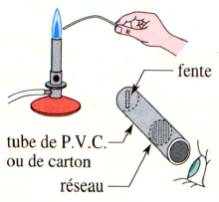
II- Les spectres d’absorption. (En relation avec le TP physique N° 6)
- Un spectre d’absorption est un spectre obtenu en analysant la lumière blanche qui a traversé une substance.
2)- Spectres de raies d’absorption.
![]() Expérience : projecteur de diapo (lampe), fente, bec
Mecker (NaCl : Chlorure de sodium), lentille, prisme, écran noir.
Expérience : projecteur de diapo (lampe), fente, bec
Mecker (NaCl : Chlorure de sodium), lentille, prisme, écran noir.
Cliquer sur l'image pour l'agrandir
- Observations :
- Le spectre de la lumière qui a traversé le gaz contenant des ions monoatomiques est un spectre continu entrecoupé de raies noires.
|
Conclusion : - Un gaz, à basse pression et à basse température, traversé par une lumière blanche donne un spectre d’absorption. - Le spectre de la lumière transmise est constitué de raies noires se détachant sur le fond coloré du spectre de la lumière blanche. - Le gaz absorbe les radiations qu’il est capable d’émettre. - Un spectre d’absorption est caractéristique de la nature chimique d’un atome ou d’un ion. |
3)- Spectres de bandes. Cas d’une solution colorée.
a)- spectre d’absorption d’une solution de permanganate de potassium.
![]() Expérience :
Expérience :
|
|
|
|
|
|
|
- Observation :
- La solution de permanganate de potassium est violette lorsqu’on l'observe à la lumière du jour.
- L’analyse de la lumière transmise par la solution de permanganate de potassium révèle la présence
d’une bande sombre dans le spectre de la lumière blanche.
- Une partie du vert et du bleu a été absorbée par la solution.
- On obtient un spectre de bandes d’absorption.
- Les radiations absorbées dépendent de la nature du milieu.
- Un spectre de bande est caractéristique de la substance dissoute.
- Spectre d’absorption de la solution jaune : rouge – orange – jaune – vert : bande noire qui va du bleu au violet.
- Spectre de la solution bleue : jaune – vert – bleu – violet : bande noire qui va du rouge à l’orange.
- Spectre de la solution violette : rouge – orange – jaune – violet : bande noire qui va du vert au bleu.
- Les connaissances sur la structure des étoiles proviennent uniquement de l’analyse du rayonnement que nous en recevons.
- Une étoile peut être considérée comme une boule de gaz sous haute pression.
- La température de l’étoile passe de plusieurs centaines de millions de degrés au centre à quelques milliers de degrés en surface.
- La plupart des étoiles comportent une atmosphère constituée d’un gaz sous basse pression.
2)- Spectre de la lumière solaire.
- Le spectre de la lumière du Soleil est la superposition de deux spectres :
- Un spectre d'émission continu et
- Un spectre de raies d’absorption.
- Conséquences :
- La présence du spectre d’émission continu montre que le Soleil est un corps chaud.
- La présence des raies noires d’absorption indique que le Soleil est entouré d’une couche extérieure gazeuse constituée d’atomes et d’ions.
- Comme toute étoile le Soleil est une énorme sphère de gaz très chauds qui produisent de la lumière.
- Le cœur de l’astre est si dense que la lumière transportant l’énergie libérée par les réactions nucléaires met environ 1 million d’années pour parvenir à la surface du Soleil.
- La surface du Soleil est appelée la Photosphère.
- La température de la photosphère est de l’ordre de 5500 °C.
- L’existence de raies d’absorption est du à la présence d’une atmosphère autour du Soleil.
- On l’appelle la chromosphère.
- Elle est constituée de gaz sous faible pression avec des régions où la température atteint 104 °C.
- Entre 300 nm et 700 nm, il existe plus de 20 000 raies répertoriées.
- L’analyse spectrale permet de connaître la composition chimique détaillée et précise du Soleil.
- Les éléments les plus abondants : H : 78,4 % en masse et He : 19,6 % en masse.
4)- Température de surface d’une étoile.
- On peut faire le classement des étoiles selon leur température de surface et leur couleur.
- La couleur d’une étoile traduit sa température.
- Une étoile bleue est plus chaude qu’une étoile jaune.
- Tableau :
|
Température Moyenne ° C |
3000 |
5500 |
8000 |
10000 |
|
Couleur |
Rouge
orangée |
Jaune |
Blanche |
bleutée |
|
Exemple |
Bételgeuse |
Le
Soleil |
Sirius |
Rigel |
|
Exercices 2005-2006 |
|
Physique et Chimie seconde Collection DURANDEAU HaCHETTE |
|
Exercice 03 page 68 |
|
Exercice 07 page 69 |
|
Exercice 10 page 69 |
|
Exercice 13 page 70 |
|
Exercice 15 page 71 |
|
Exercice 19 page 71 |
|
Physique et Chimie seconde |
|
Collection Microméga Hatier Ancienne édition |
|
1)- Exercice 3 page 222. |
|
2)- Exercice 4 page 222. |
|
3)- Exercice 5 page 222. |
|
4)- Exercice 12 page 222. |
|
5)- Exercice 14 page 222. |
|
6)- Exercice 16 page 223. |