|
TP Chimie. N° 08 |
Titrage conductimétrique. Correction |
|
|
|
|
Objectifs : |
- Connaître
le principe du dosage.
- Déterminer la
concentration d’une solution d’acide chlorhydrique. - Déterminer la concentration molaire
- Puis le pourcentage massique en hydroxyde de
sodium d’un produit pour déboucher les canalisations. |
|
II - Titrage d'une solution d'acide chlorhydrique par conductimétrie. |
- Le but du titrage ou d’un dosage est de déterminer la concentration molaire d’une espèce chimique M présente dans un volume donné et précis d’une solution.
- L’outil de détermination de cette quantité de matière est la réaction chimique :
- C’est la réaction de dosage.
- Cette réaction doit être rapide, totale, spécifique et unique.
- De plus cette transformation doit présenter une caractéristique physique variant au cours du dosage et facilement mesurable, ceci afin de suivre l’évolution du système.
II- Titrage de la solution d’acide chlorhydrique par conductimétrie.
- La solution aqueuse SA d’acide chlorhydrique utilisée est de concentration CA inconnue.
- Le but est de la titrer à l’aide d’une solution aqueuse SB d’hydroxyde de sodium.
- Des volumes de solution aqueuse SB d’hydroxyde de sodium (base) sont ajoutés progressivement dans un volume donné VA de solution aqueuse SA d’acide chlorhydrique.
- On effectue après chaque ajout une mesure de conductance.
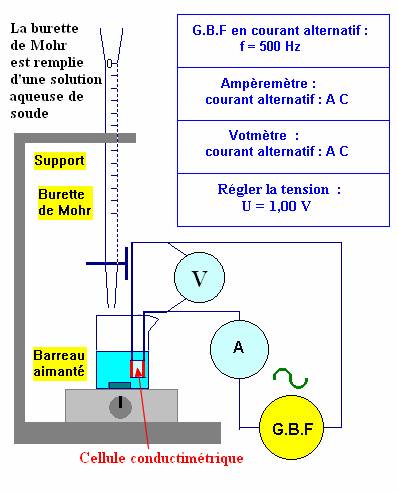
![]() Remplir une burette graduée (25 mL) avec une solution aqueuse
SB
d’hydroxyde de sodium de concentration molaire
Remplir une burette graduée (25 mL) avec une solution aqueuse
SB
d’hydroxyde de sodium de concentration molaire
-
CB
= 5,00 x 10 – 2
mol / L,
en prenant le soin de respecter le protocole décrit par le professeur (rinçage,
bulle d’air, niveau,…)
- Avec une pipette jaugée, munie de sa propipette, prélever un volume VA = 20,0 mL de solution aqueuse SA d’acide chlorhydrique à titrer.
- Les verser dans un bécher de 100 mL. Plonger la cellule conductimétrique et ajouter de l’eau distillée afin d’immerger les électrodes.
- Ajouter 3 gouttes de B.B.T.
- Réaliser le montage électrique permettant de mesurer la conductance G de la solution.
- Placer le bécher sur l’agitateur magnétique et la burette au-dessus du bécher, de façon à ce que la solution qu’elle contient puisse s’écouler dans le bécher sans obstacle.
- Noter la couleur de la solution après chaque ajout.
- Faire un schéma légendé du montage en indiquant les volumes et les concentrations connus.
|
CB |
0,050 |
mol
/ L |
|
Veq |
? |
mL |
|
VA |
20,0 |
mL |
|
CA |
? |
mol
/ L |
- Régler la fréquence du générateur sur 500 Hz, sélectionner le signal sinusoïdal et régler la valeur de la tension U = 1,00 V,
- Mesurer la valeur de l’intensité I du courant dans le circuit.
![]() En déduire la valeur de la conductance
G0
de la solution SA
d’acide chlorhydrique avant addition de la solution
SB
d’hydroxyde de sodium.
En déduire la valeur de la conductance
G0
de la solution SA
d’acide chlorhydrique avant addition de la solution
SB
d’hydroxyde de sodium.
|
|
4,15 mA |
|
U (V) |
1,00 V |
|
G mS |
4,15 mS |
|
Couleur de la solution |
Jaune |
![]() Ajouter un volume
V1
= 1,0 mL de solution SB
d’hydroxyde de sodium dans le bécher.
Ajouter un volume
V1
= 1,0 mL de solution SB
d’hydroxyde de sodium dans le bécher.
- Mesurer U et I.
- Déterminer la valeur de la conductance G1.
- Noter la couleur de la solution.
![]() Quels sont les ions présents dans le bécher avant addition de
la solution d’hydroxyde de sodium (soude) ?
Quels sont les ions présents dans le bécher avant addition de
la solution d’hydroxyde de sodium (soude) ?
|
- Avant addition de soude, on est en présence d’une
solution aqueuse d’acide chlorhydrique. - Elle contient les ions oxonium
H3O+
(aq) et les ions chlorure
Cl–
(aq). |
![]() Quels sont les ions présents dans le bécher après addition de
soude ? Y a-t-il eu une transformation chimique ?
Quels sont les ions présents dans le bécher après addition de
soude ? Y a-t-il eu une transformation chimique ?
![]() Si oui, quelle est l’équation bilan associée ? De quel
type de réaction s’agit-il ?
Si oui, quelle est l’équation bilan associée ? De quel
type de réaction s’agit-il ?
|
- À l’état initial, avant toute réaction, après
addition de soude, le mélange réaction comprend : - Les ions oxonium
H3O+
(aq) et les ions chlorure
Cl–
(aq) (acide chlorhydrique) - Les ions sodium
Na+
(aq) et les ions hydroxyde
HO–
(aq) (La soude). - On remarque que le mélange réactionnel contient - les ions oxonium H3O+ (aq), acide du couple H3O+ / H2O - et
les ions hydroxyde HO–
(aq), base du couple
H2O
/ HO –. - Il se produit une réaction acido-basique entre les ions
oxonium et les ions hydroxyde :
H3O+
(aq) +
HO–
(aq)
→ 2
H2O - Les ions sodium Na+ (aq) et les ions chlorure Cl– (aq) ne participent pas à la réaction, - ce sont des ions spectateurs. -
Toutefois, ils assurent la neutralité électrique de la
solution. |
![]() Comment interpréter le fait que la conductance
G1 soit
plus faible que la conductance G0 ?
Comment interpréter le fait que la conductance
G1 soit
plus faible que la conductance G0 ?
|
λ
(H3O+) |
3,50
× 10– 2 |
S . m2.
mol – 1 |
|
λ
(Cl–) |
7,63 ×
10– 3 |
S . m2 .
mol – 1 |
|
λ
(Na+) |
5,01
× 10– 3 |
S . m2 .
mol – 1 |
|
λ
(HO–) |
1,99
× 10– 3 |
S . m2 .
mol – 1 |
|
- Lors de l’ajout de soude dans la solution d’acide chlorhydrique, - il se produit une réaction acido-basique : - Il disparaît une partie des ions oxonium H3O+ (aq) - et autant d’ions hydroxyde HO– (aq). - Ces ions réagissent et s’éliminent simultanément - Lorsqu’on verse de la soude, - on ajoute des ions hydroxyde HO– (aq) - et autant d’ions sodium Na+ (aq) qui ne réagissent pas. - Tout se passe comme si les ions oxonium H3O+ (aq) avaient été remplacés - par les ions sodium Na+ (aq). - Comme la conductivité molaire ionique - des ions sodium Na+ (aq) (5,01 mS.m 2.mol – 1) est inférieure - à la conductivité molaire ionique des ions oxonium H3O+ (aq) (35,0 mS.m2.mol– 1), - la conductivité de la solution diminue. |
![]() Ajouter successivement des volumes de solution de soude égaux
à 1,0 mL jusqu’à ce que le volume total ajouté soit
V
= 17 mL.
Ajouter successivement des volumes de solution de soude égaux
à 1,0 mL jusqu’à ce que le volume total ajouté soit
V
= 17 mL.
- Après chaque ajout de solution de soude, déterminer la valeur de la conductance G de la solution, noter sa couleur et indiquer le réactif limitant.
![]() Reporter les résultats dans un tableau en notant
V
(OH–)
le volume total de soude versée.
Reporter les résultats dans un tableau en notant
V
(OH–)
le volume total de soude versée.
- Groupe 1 : Tableau de valeurs.
|
V (OH–)
mL |
0,00 |
1,00 |
2,00 |
3,00 |
4,00 |
5,00 |
6,00 |
7,00 |
8,00 |
9,00 |
10,00 |
11,00 |
12,00 |
|
G (mS) |
8,38 |
8,15 |
7,88 |
7,61 |
7,41 |
7,13 |
6,83 |
6,64 |
6,36 |
6,11 |
5,88 |
5,62 |
5,34 |
|
Couleur |
J |
J |
J |
J |
J |
J |
J |
J |
J |
J |
J |
J |
J |
|
V (OH–)
mL |
13,00 |
14,00 |
15,00 |
16,00 |
17,00 |
18,00 |
19,00 |
20,00 |
21,00 |
22,00 |
23,00 |
24,00 |
25,00 |
|
G (mS) |
5,08 |
4,84 |
4,53 |
4,21 |
3,93 |
3,57 |
3,28 |
2,96 |
3,33 |
3,56 |
3,76 |
3,91 |
4,04 |
|
Couleur |
J |
J |
J |
J |
J |
J |
J |
J |
B |
B |
B |
B |
B |
- Groupe 2 : Tableau de valeurs.
|
V (OH–)
mL |
0,00 |
1,00 |
2,00 |
3,00 |
4,00 |
5,00 |
6,00 |
7,00 |
8,00 |
9,00 |
10,00 |
11,00 |
12,00 |
|
G (mS) |
10,40 |
10,40 |
9,93 |
9,59 |
9,30 |
8,98 |
8,67 |
8,30 |
7,93 |
7,54 |
7,13 |
6,77 |
6,41 |
|
Couleur |
J |
J |
J |
J |
J |
J |
J |
J |
J |
J |
J |
J |
J |
|
V (OH–)
mL |
13,00 |
14,00 |
15,00 |
16,00 |
17,00 |
18,00 |
19,00 |
20,00 |
21,00 |
22,00 |
23,00 |
24,00 |
25,00 |
|
G (mS) |
6,04 |
5,68 |
5,45 |
5,02 |
4,65 |
4,22 |
3,77 |
3,38 |
3,58 |
3,68 |
3,96 |
4,22 |
4,44 |
|
Couleur |
J |
J |
J |
J |
J |
J |
J |
J |
B |
B |
B |
B |
B |
![]() Tracer sur une feuille de papier millimétré le graphe des variations
de G
en fonction de V (OH–).
Tracer sur une feuille de papier millimétré le graphe des variations
de G
en fonction de V (OH–).
- Graphe du groupe 1 :
- Graphe du groupe 2 :
![]() Décrire la courbe obtenue.
Décrire la courbe obtenue.
![]() Le
graphe fait apparaître un point singulier, dont l’abscisse est notée
Veq.
Quelle est la valeur de Veq ?
Le
graphe fait apparaître un point singulier, dont l’abscisse est notée
Veq.
Quelle est la valeur de Veq ?
|
-
Pour : 0,0 mL
≤
V
(OH–)
≤
20.0 mL, les points sont sensiblement alignés - Le coefficient directeur du segment de droite obtenue est négatif. - La conductance diminue. -
Pour : 20.0 mL
≤
V
(OH–)
≤
25.0 mL, les points sont sensiblement alignés - Le coefficient directeur du segment de droite obtenue est positif. - La conductance augmente. - L’abscisse du point d’intersection des deux segments de droite : Veq ≈ 20,0 mL. |
|
Interprétation :
- Avant l’équivalence, la solution est jaune : elle est acide, - il y a des ions oxonium H3O+ dans le bécher. - Seulement une partie des ions oxonium H3O+ a réagi. - Par contre tous les ions hydroxyde OH – ont réagi. - Les ions hydroxyde OH– constituent le réactif limitant et la conductance diminue. - Après l’équivalence, la solution est bleue, elle est basique. - Il y a des ions hydroxyde OH– dans le bécher. - Tous les ions oxonium H3O+ ont réagi. - Les ions oxonium H3O+ constituent le réactif limitant. - Tout se passe comme si on ajoutait des ions hydroxyde OH– - et des ions sodium Na+ dans la solution : - La conductance augmente. |
![]() Pour quel volume approximatif de soude versée y a-t-il eu
changement de couleur de la solution ?
Pour quel volume approximatif de soude versée y a-t-il eu
changement de couleur de la solution ?
|
ʘ - L’équivalence dans un titrage correspond au changement de réactif limitant. - A l’équivalence, il n’y pas de réactif limitant :
tous les réactifs ont réagi.
ʘ définies par les coefficients de la réaction. |
![]() Calculer la quantité de matière
neq
(OH–
) des ions hydroxyde
versé à l’équivalence.
Calculer la quantité de matière
neq
(OH–
) des ions hydroxyde
versé à l’équivalence.
|
- Quantité de matière
neq
(OH
–
) des ions hydroxyde versé à l’équivalence :
|
![]() Sachant qu’à l’équivalence, tous les ions hydroxyde
OH–
(aq) introduits dans le bécher ont réagi avec tous les ions oxonium
H3O+
(aq), initialement
présents dans le bécher,
Sachant qu’à l’équivalence, tous les ions hydroxyde
OH–
(aq) introduits dans le bécher ont réagi avec tous les ions oxonium
H3O+
(aq), initialement
présents dans le bécher,
- déterminer la quantité de matière ni (H3O+) des ions oxonium initialement présents dans le bécher.
![]() En déduire la valeur
de la concentration CA de
la solution aqueuse SA d’acide chlorhydrique utilisée.
En déduire la valeur
de la concentration CA de
la solution aqueuse SA d’acide chlorhydrique utilisée.
|
- À
l’équivalence,
ni
(H3O
+)
=
neq
(OH–)
- Groupe 2 :
|
||||||||||||||||||||||||||||||||||||||
![]() Faire un tableau d’avancement pour
VB =
5,0 mL, VB =
Veq
et VB =
25
mL
Faire un tableau d’avancement pour
VB =
5,0 mL, VB =
Veq
et VB =
25
mL
|
Équation |
H3O+ (aq) |
+ HO– (aq) |
→ |
2 H2O (ℓ) |
|
Na+
(aq) |
Cl–
(aq) |
|
|
État du
système |
Avanc. |
mmol |
mmol |
|
excès |
|
mmol |
mmol |
|
État initial
(mol) |
x = 0 |
n1
= CA
.
VA |
n2
=
CB
.
VB |
excès |
|
CB.
VB |
CA.
VA |
|
|
1,00
|
0 |
|
|
|
0 |
1,00 |
||
|
Au cours
de la
transformation |
x |
CA. VA
–
x |
CB
. VB –
x |
excès |
|
|
|
|
|
État
final |
x = xmax |
CA
. VA –
xmax |
CB
. VB –
xmax |
|
excès |
|
|
|
|
État
pour
VB = 5,0 mL |
xmax =
0,25 |
1,00
– 0,25 =
0,75 |
0,25
- 0,25
=
0 |
|
excès |
|
0,25 |
1,00 |
|
Equivalence
VB
=
V
eq |
xmax =
1,00 |
1,00
– 1,00
=
0 |
1,00
– 1,00
=
0 |
|
excès |
|
1,00 |
1,00 |
|
État
pour
VB = 25 mL |
xmax =
1,00 |
1,00
– 1,00
=
0 |
1,25
– 1,00
=
0,25 |
|
excès |
|
1,25 |
1,00 |
III- Titrage d’un produit ménager.
- L’objectif de ce titrage est de vérifier les indications portées sur l’emballage du produit ménager.
a)- Préparation :
|
il faut utiliser les gants et les lunettes |
· Relever les indications portées sur la bouteille et lire les consignes de sécurité. Le fabricant donne le pourcentage massique, le noter sur la feuille. · La solution commerciale S est trop concentrée, il faut la diluer 50 fois. On dispose d’une solution S1 obtenue après avoir dilué 10 fois la solution commerciale S. Il faut effectuer une autre dilution
sur la solution
S1. · Indiquer le mode opératoire de la dilution à faire pour préparer un volume V = 250 mL de la solution finale S2. |
- Mode opératoire de la dilution (5 fois) à faire pour préparer un volume V2 = 250 mL de la solution finale S2.
- Préparation de la solution à doser :
|
S1 |
{ |
C1 = |
Dilution |
S2 |
{ |
C2 = C1 / 5 |
|
V1 = 50,0 mL |
→ |
V2 = 250 mL |
||||
|
n1 = C1 . V1 |
|
n2 = C2 . V2 |
||||
|
Solution mère |
|
Solution fille |
||||
- Au cours de la dilution, il y a
conservation de la quantité de matière de soluté :
- n
1 = n2 => C1 . V1 = C2 . V2|
Verser suffisamment de solution Mère dans un bécher |
Deuxième étape : On prélève le volume nécessaire de solution Mère à l’aide d’une fiole jaugée de 50 mL |
Troisième étape : On verse le volume nécessaire de solution dans la fiole jaugée de volume approprié. |
|
On ne pipette jamais directement dans le flacon qui contient la
solution
Mère |
|
|
|
Quatrième étape : On ajoute de l’eau distillée et on agite pour mélanger et homogénéiser |
Cinquième étape : On complète avec une pissette d’eau distillée jusqu’au trait de jauge. |
Sixième étape : on agite pour homogénéiser. La solution est prête. |
|
|
|
|
b)- Dosage :
- On remplit une burette graduée (25 mL) avec une solution aqueuse SA d’acide chlorhydrique de concentration molaire CA = 1,00 × 10– 1 mol / L.
- Avec une pipette munie de sa propipette, on prélève un volume V2 = 10,0 mL de solution S2.
- On les verse dans un bécher propre, puis on plonge la cellule conductimétrique.
-
On ajoute de l’eau distillée afin d’immerger les électrodes,
3 gouttes de B.B.T et un barreau
aimanté.
- On réalise le montage électrique permettant de mesurer la conductance G de la solution.
- On ajoute successivement des volumes de solution SA d’acide chlorhydrique égaux à 1,0 mL jusqu’à ce que le volume total ajouté soit V = 25 mL.
- Après chaque ajout, on détermine la valeur de la conductance G de la solution.
- On donne le tableau de valeurs :
|
VA (mL) |
0,00 |
1,00 |
2,00 |
3,00 |
4,00 |
5,00 |
6,00 |
7,00 |
8,00 |
9,00 |
10,0 |
11,0 |
|
G (mS) |
5,12 |
4,90 |
4,62 |
4,40 |
4,14 |
3,98 |
3,79 |
3,54 |
3,36 |
3,20 |
2,98 |
2,78 |
|
Couleur |
B |
B |
B |
B |
B |
B |
B |
B |
B |
B |
B |
B |
|
VA (mL) |
12,0 |
13,0 |
14,0 |
15,0 |
16,0 |
17,0 |
18,0 |
19,0 |
20,0 |
21,0 |
22,0 |
25,0 |
|
G (mS) |
2,57 |
2,53 |
3,08 |
3,78 |
4,38 |
4,92 |
5,48 |
5,95 |
6,57 |
6,85 |
7,41 |
8,48 |
|
Couleur |
B |
B |
J |
J |
J |
J |
J |
J |
J |
J |
J |
J |
2)- Exploitation :
![]()

![]() Écrire l’équation bilan de la réaction de titrage.
Écrire l’équation bilan de la réaction de titrage.
|
- Il se produit une réaction acido-basique entre les ions
oxonium et les ions hydroxyde : H3O+ (aq) + HO– (aq) → 2 H2O (ℓ) - Les ions sodium Na+ (aq) et les ions chlorure Cl– (aq) ne participent pas à la réaction, - ce sont des ions spectateurs. -
Toutefois, ils assurent la neutralité électrique de la
solution. |
![]()
![]() Déterminer sur le graphique le point d’équivalence et donner
ses coordonnées.
Déterminer sur le graphique le point d’équivalence et donner
ses coordonnées.
|
- Point d’équivalence
E :
- Geq
= 2,4 mS et Veq
= 12,6 mL |
![]() Établir l’expression littérale de la concentration
C2 de
la solution S2.
Puis celle
C de la solution commerciale
S. Calculer la
valeur de C.
Établir l’expression littérale de la concentration
C2 de
la solution S2.
Puis celle
C de la solution commerciale
S. Calculer la
valeur de C.
|
- A l’équivalence, les réactifs ont été mélangés
dans les proportions stœchiométriques - A l’équivalence, ni (OH –) = neq (H 3O +)
- Concentration de la solution S : - C
= - C
≈ 6,30 mol / L |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
![]() Le produit commercial a une densité
d
= 1,23. Rappeler la définition de la densité d
d’un liquide.
Le produit commercial a une densité
d
= 1,23. Rappeler la définition de la densité d
d’un liquide.
- Comment faire pour déterminer facilement la valeur de la densité d d’une solution au laboratoire ?
|
-
Détermination de la densité :
|
||||||||||||||||||||||||||||||||||||||||
![]()
|
- Pourcentage massique :
- Incertitude relative :
- La précision est de 2,5 %. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
- Comparer avec la valeur relevée sur la bouteille et conclure.
|
- Le fabricant annonce 20 %. -
La mesure est en accord avec
la valeur donnée par le fabricant ceci à 2,5 % près |
![]() Faire un tableau d’avancement pour
VA =
5,0 mL, VA =
Veq
et VA = 20
mL
Faire un tableau d’avancement pour
VA =
5,0 mL, VA =
Veq
et VA = 20
mL
|
Équation |
H3O+ (aq) |
+ HO– (aq). |
→ |
2 H2O (ℓ) |
|
Na+ (aq) |
Cl– (aq) |
|
|
État du
système |
Avanc. |
mmol |
mmol |
|
excès |
|
mmol |
mmol |
|
État initial
(mol) |
x
= 0 |
n1 =
CA. VA 0
|
n2 =
CB
. VB 1,26 |
excès |
|
CB. VB 1,26 |
CA. VA 0 |
|
|
Au cours
de la
transformation |
x |
CA.
VA
–
x |
CB
.
VB –
x |
excès |
|
|
|
|
|
État final
(mol) |
x
= xmax |
CA.
VA –
xmax |
CB
.
VB –
xmax |
|
excès |
|
|
|
|
État
pour
VA
= 5,0 mL |
xmax =
0,500 |
0
Réactif limitant |
1,26
– 0,500 =
0,76 |
|
excès |
|
1,26
|
0,500
|
|
Équivalence
VA
= Veq |
xmax =
1,26 |
0 |
0 |
|
excès |
|
1,26
|
1,26
|
|
Mélange stœchiométrique |
||||||||
|
État
pour
VA
= 20 mL |
xmax =
1,26 |
0,74
|
0
Réactif limitant |
|
excès |
|
1,26
|
2,00
|
|
- Avant l’équivalence, le réactif limitant est l’ion
oxonium H3O+
(aq). - À l’équivalence, il n’y a pas de réactif limitant. - Les réactifs ont été mélangés dans les proportions stœchiométriques. - Après l’équivalence, le réactif limitant est l’ion hydroxyde HO– (aq). - Au cours du dosage, on a changé de réactif limitant. - L’équivalence dans un titrage correspond au changement de réactif limitant. |