|
TP Chimie. N° 06 |
Concentration et conductimétrie. Enoncé. |
|
|
|
|
But : détermination de la concentration d’un sérum physiologique |
|
2)- Etalonnage du conductimètre. 2)- Préparation du sérum pour la mesure. |
|
Matériel : |
- Un G.B.F, deux multimètres (un noir et un jaune), une cellule de conductimétrie, - Des fils de connexion, - Des fioles jaugées de 100 mL, des pipettes graduées ou des pipettes jaugées (à voir), - Un flacon de sérum physiologique, de l’eau distillée, - Une solution de chlorure de sodium de concentration : - C0 = 1,0 mmol / L. C1 = 2 mmol / L, C2 = 3 mmol / L, C3 = 4 mmol / L, - C4 = 5 mmol / L, C5 = 6 mmol / L, C6 = 7 mmol / L, C7 = 8 mmol / L, - C8 = 9 mmol / L, C9 = 10 mmol / L, C10 = 12 mmol / L, C11 = 14 mmol / L |
|
Objectifs :
- Tracer
une courbe d’étalonnage. - Le sérum physiologique est une solution aqueuse de chlorure de sodium.
-
Le but de cette
manipulation est de déterminer la concentration molaire de ce sérum en
utilisant la conductimétrie. |
- Schéma et montage :
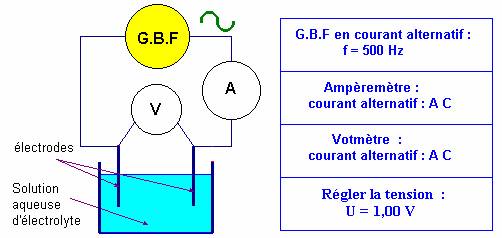
|
|
- Schématiser et effectuer le montage du conductimètre.
2)- Étalonnage du conductimètre.
![]() Plonger la cellule dans un bécher contenant de l’eau distillée.
Plonger la cellule dans un bécher contenant de l’eau distillée.
- Réglage du G.B.F : régler la fréquence sur 500 Hz et la valeur de la tension sur U = 1,0 V
(Cette valeur doit être maintenue constante au cours de l’expérience).
- Mesurer la valeur de l’intensité Ib.
- Ceci constitue le « blanc ».
- On quantifie ici la présence d’éventuelles impuretés dans l’eau.
- La valeur mesurée devra être systématiquement soustraite des autres valeurs mesurées pour éliminer la contribution de ces impuretés.
![]() Plonger successivement la cellule dans les douze solutions d’étalonnage.
Plonger successivement la cellule dans les douze solutions d’étalonnage.
- Pour chaque mesure, vérifier la valeur de la tension (U = 1,0 V) avant de relever la valeur de l’intensité I.
- Penser à rincer la cellule après chaque mesure puis à éliminer la majeure partie de l’eau de rinçage (papier joseph) sans perturber la cellule.
- Au début de la mesure suivante, agiter doucement la cellule pour bien homogénéiser.
Animation CabriJava pour effectuer les mesures
![]() Reproduire et compléter le tableau suivant :
Reproduire et compléter le tableau suivant :
|
C (mmol / L) |
0,0 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
7,0 |
8,0 |
9,0 |
10,0 |
12,0 |
14,0 |
|
I (mA) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G (mS) |
|
|
|
|
|
|
|
|
|
|
|
|
|
2)- Préparation du sérum pour la mesure.
a)- concentration massique de la solution de sérum physiologique :
- Relever l’indication que porte le flacon de sérum physiologique acheté en pharmacie.
![]() En déduire la valeur de la concentration molaire
CS.
En déduire la valeur de la concentration molaire
CS.
b)- Dilution.
![]() Cette solution étant trop concentrée, il faut la diluer 20 fois
(9,0 g / L) ou 100 fois.
Cette solution étant trop concentrée, il faut la diluer 20 fois
(9,0 g / L) ou 100 fois.
- Proposer un mode opératoire permettant de préparer 100 mL de solution diluée.
- La préparer et effectuer la mesure.
III- Exploitation des résultats.
![]() Tracer la courbe d’étalonnage représentative de la variation
de la conductance
G
en fonction de la concentration
C :
Tracer la courbe d’étalonnage représentative de la variation
de la conductance
G
en fonction de la concentration
C :
- G = f (C).
- Donner les caractéristiques de la courbe obtenue.
- Quelle allure aurait cette courbe si on ne tenait pas compte du « blanc » ?
- Quelle relation simple existe-t-il entre la concentration et la conductance lorsque l’électrolyte est suffisamment dilué ?
- Donner cette relation.
- Que se passe-t-il lorsque l’électrolyte est trop concentré ?
- À l’aide de la courbe, déduire la concentration molaire en chlorure de sodium de la solution diluée de sérum physiologique.
- En déduire la concentration molaire correspondante à la solution commerciale.
- La comparer à la valeur CS.
- Conclusion.
|
Détermination
de la concentration d’une solution L’hypocalcémie, carence de l’organisme en élément calcium, peut être traitée par injection intraveineuse d’une solution de chlorure de calcium (Ca 2+ (aq) + 2 Cl - (aq)).
Pour déterminer sa concentration C, on utilise une méthode conductimétrique. 1. On dispose, pour étalonner la cellule conductimétrique,
de solutions étalons
Si
de concentrations connues
Ci. - Le tableau suivant fournit les conductances
Gi
de
ces différentes solutions.
- Tracer la courbe
G
= f
(C). 2. Le contenu d’une ampoule de solution injectable a été dilué 100 fois. La mesure de la conductance de la solution diluée, avec la même cellule conductimétrique et à la même température, donne : G’
= 2,71 mS. a. Déterminer la valeur de la concentration
C’
de la solution diluée. b. En déduire la concentration
C
de la solution injectable. c. Pourquoi a-t-il été nécessaire de diluer cette
solution ? 3. Déterminer l’apport calcique, c’est-à-dire la quantité d’élément calcium, d’une ampoule de solution
injectable de 10,0 mL. |